Nature Biotechnology | 靶向病灶的“智能活胶水”:针对炎症性肠病的活体治疗新策略
在自然界中,海洋藤壶和沙堡蠕虫能够根据所处环境信息原位分泌黏附物质,并在复杂水环境中牢固定植。这种“可感知、可响应”的动态黏附,已成为合成生物学与材料科学交汇的重要灵感来源。回到临床现实,炎症性肠病(Inflammatory Bowel Disease, IBD)患者常伴随肠黏膜反复损伤、慢性炎症甚至出血。现有医用粘合剂多为“静态材料”,难以在湿润、蠕动的肠道环境中稳定发挥作用,往往还需依赖影像学或侵入性操作来定位病灶。如何让治疗材料在体内实现“自动黏附病灶、自主发挥作用”,仍是该领域的核心挑战。
1月19日,由中国科学院深圳先进技术研究院定量合成生物学全国重点实验室、合成生物学研究所钟超研究员与深圳大学医学部黄鹏教授领衔的研究团队,在国际学术期刊Nature Biotechnology发表重要研究成果,提出一种面向炎症性肠病精准治疗的智能活胶水(Therapeutic Living Glue, TL-glue)。该材料系统的核心突破在于,能够自主感知肠道疾病相关信号,并在病灶部位原位形成同时具备黏附与治疗功能的生物胶基质,实现“感知—定位—治疗”一体化的精准干预。研究将血液信号感知、动态生物黏附以及治疗因子的持续释放整合于单一工程化活体材料体系中,不仅为炎症性肠病的靶向干预提供了全新思路,也为构建更具临床可达性与持久性的智能微生物治疗系统奠定了基础。

文章上线截图
原文链接:https://www.nature.com/articles/s41587-025-02970-9
从领域认知到科学假设
医用粘合剂在止血和组织修复领域已被广泛应用,但在胃肠道这样湿润、蠕动频繁且环境复杂的体系中,其黏附稳定性和定位准确性仍然面临巨大挑战。近年来,合成生物学与材料科学交叉催生了“工程活材料”(Engineered Living Materials, ELMs)这一新兴方向,目标是赋予材料类似生物系统的环境感知与功能响应能力。研究团队此前曾探索通过光或小分子诱导的方式调控工程微生物的黏附行为,但这类方法高度依赖外源刺激,难以适应体内病灶环境的动态变化(An et al., Matter, 2020)。基于这一局限,研究团队将目光投向疾病本身所提供的天然信号——出血。对于炎症性肠病而言,出血不仅是症状,更是病灶位置直接可靠的标志。由此,团队提出关键科学假设:是否可以利用血液或血红素作为触发信号,构建一种在微量出血处自动启动、原位形成黏附基质并同步释放修复因子的“智能活胶水”系统?
智能活胶水如何实现“自主诊疗”
围绕这一构想,研究团队以人体肠道常驻微生物——大肠杆菌为“底盘”,构建了一套多功能、高度协同的智能活胶水系统。该系统由三个核心模块组成,共同完成从识别到修复的闭环响应(图1):
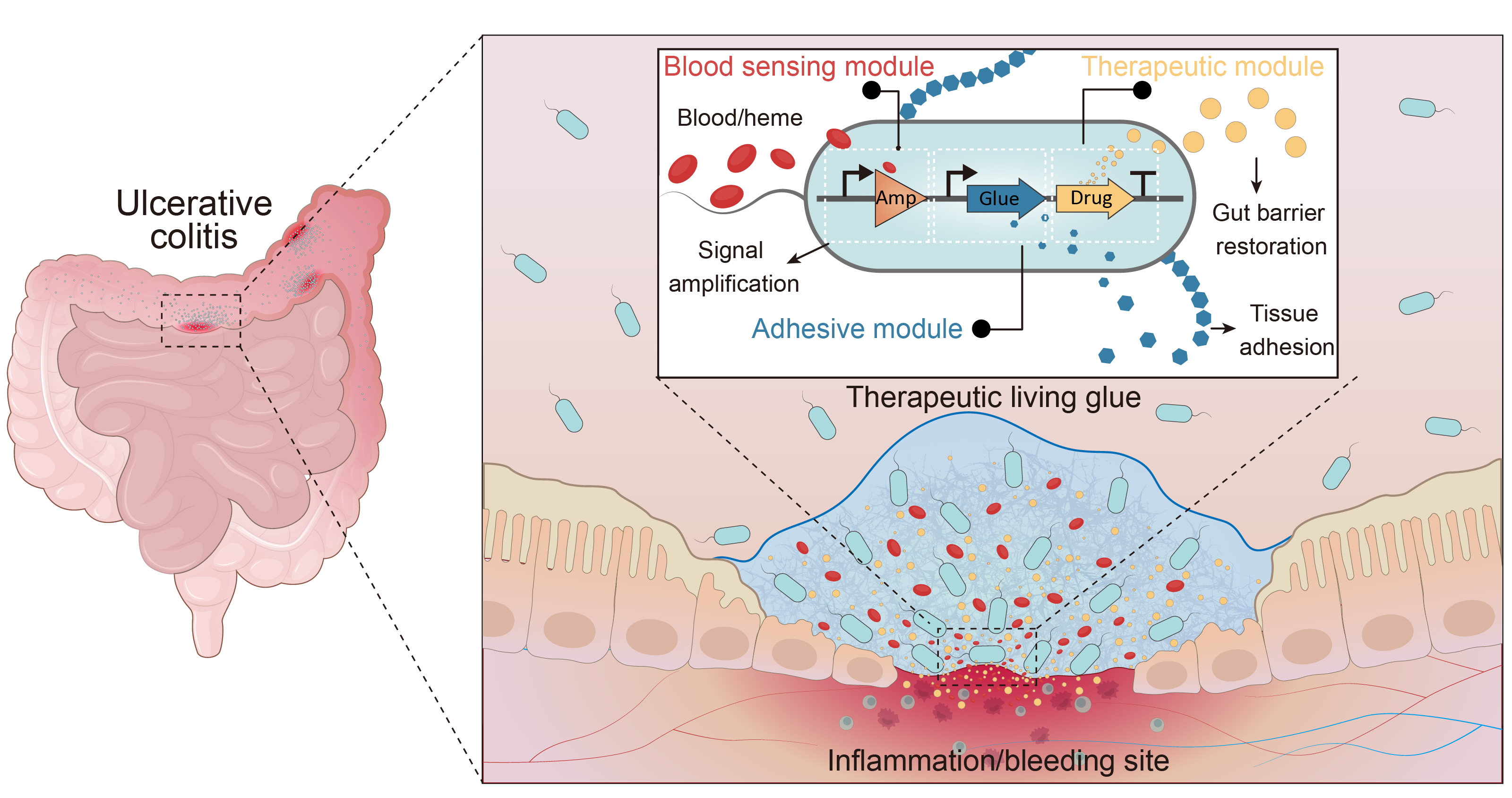
图1. 智能活胶水用于精准靶向与治疗炎症性肠病
1. 高灵敏血液感应模块——疾病的“信号探测器”:研究团队首先构建了一套可灵敏识别血液信号的基因感应电路。此前,麻省理工学院Timothy K. Lu教授团队曾提出血红素响应型生物传感器,用于肠道出血监测(Mimee et al., Science, 2018),但该系统主要适用于信号检测,其输出能力不足以支持后续治疗分子的高效合成。为解决这一问题,研究团队引入三层转录放大器,并系统优化转录因子HrtR表达强度及血液响应启动子HrtO的操纵子拷贝数,使基因线路在体外实现百倍级响应增强,并可在低至100 ppm血液条件下产生显著输出(图2)。在IBD出血模型中,该电路能够快速被激活,而在无出血条件下保持沉默,显示出良好的疾病依赖性。
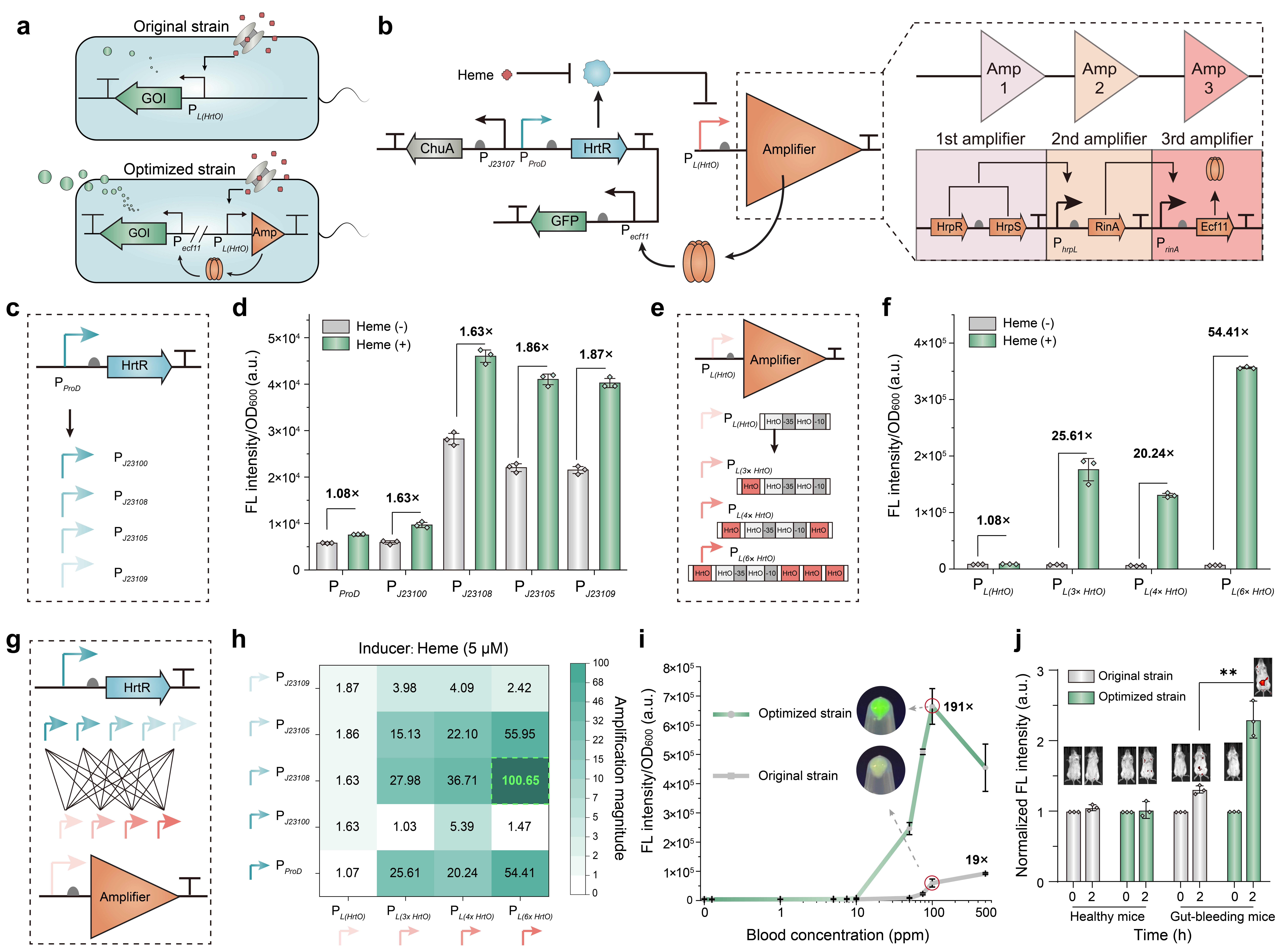
图 2. 高信噪比血液诱导基因线路的构建与系统优化
2. 动态生物黏附模块——仿生“生物胶水”:当工程菌检测到血液信号后,即启动黏附程序,分泌来源于海洋藤壶的水泥蛋白(如CP43K),这类蛋白可在水环境中自组装形成稳定的黏附基质。相较细菌生物被膜体系(如 Curli 纤维),藤壶水泥蛋白具有更好的生物相容性,并显示出一定的抗炎潜力。在体外猪肠组织黏附实验及微流控“出血缺损”模拟系统中,活胶水能够在血红素泄漏处原位形成密封层,并显著提升抗压和防漏能力,验证了其“按需粘合”的功能特性(图3)。

图 3. 工程活胶水的设计与功能验证
3. 同步修复治疗模块——智能的“修复工厂”:考虑到IBD的核心病理在于黏膜屏障受损,研究团队在黏附基质基础上进一步引入黏膜修复肽TFF3,构建治疗型活胶水TL-glue。该系统在出血触发下,不仅形成黏附保护层,还能同步释放修复因子,实现定位与治疗的协同。成像结果显示,TL-glue在小鼠肠炎模型中具有更持久的在体信号,提示其在炎症/出血环境中具备更强的黏膜停留能力和持续作用潜力。
工程活胶水TL-glue在急慢性结肠炎中的疗效验证
在葡聚糖硫酸钠(DSS)诱导的急性结肠炎模型中,TL-glue在体重、疾病活动指数、结肠长度及组织损伤等指标上均表现出显著改善(图4)。基于光声/超声成像的血红蛋白检测进一步表明,TL-glue组出血相关信号明显降低。组织学与免疫分析显示,其可促进隐窝结构和杯状细胞恢复,提高Mucin-2、E-cadherin及ZO-1/Occludin等屏障标志物水平,同时降低促炎因子、提升抗炎因子,形成“止血—修复—抗炎”的功能闭环。
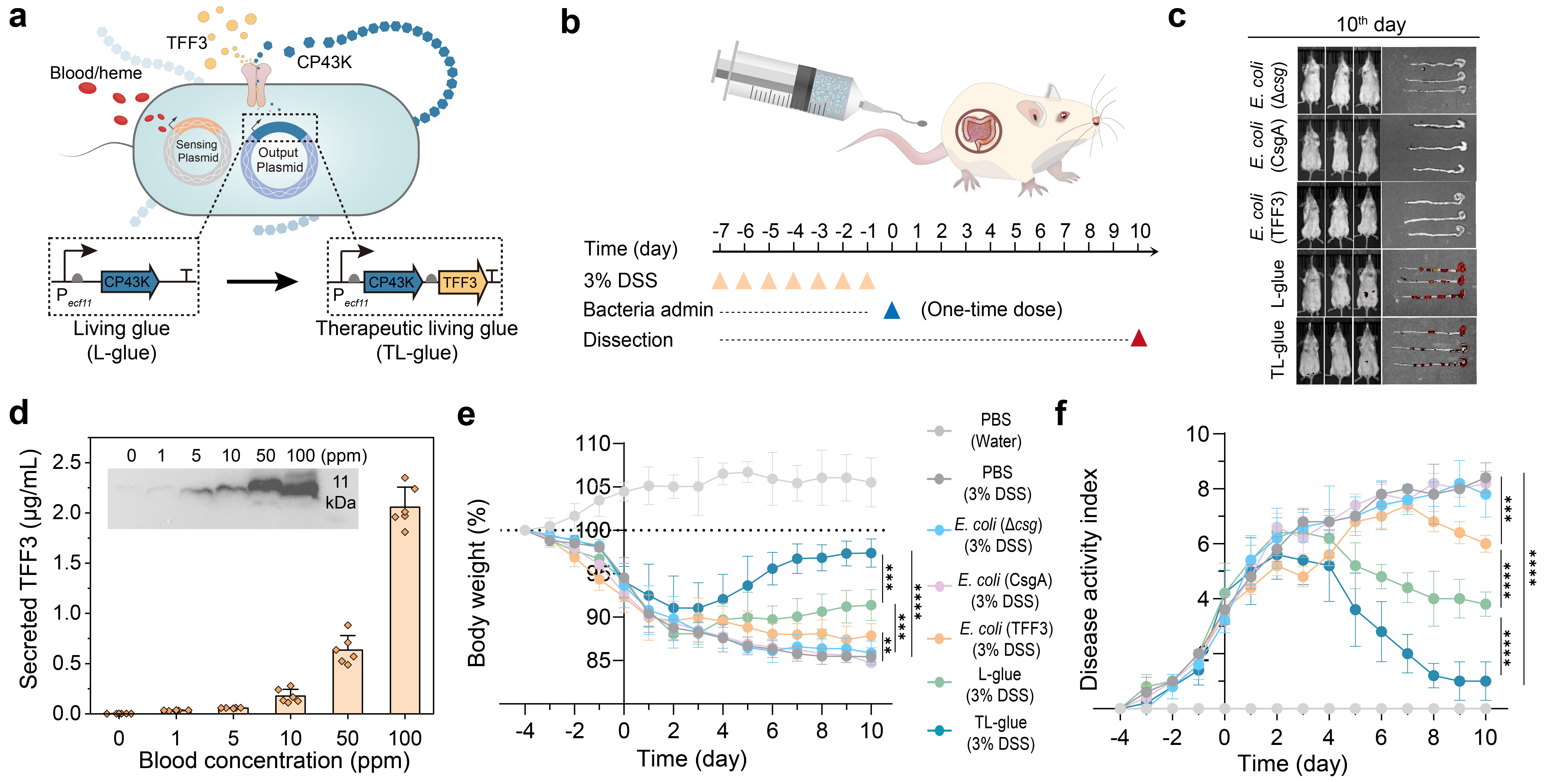
图4. 工程活胶水在炎症性肠病模型中的在体疗效评估
在更接近慢性免疫紊乱特征的IL-10⁻/⁻自发性结肠炎模型中,TL-glue同样在多项疾病指标和组织学层面展现出稳定疗效,进一步验证了其对慢性病程的干预潜力。此外,研究还探索了口服递送方案,通过肠溶包裹实现胃酸保护与肠道释放。结果显示,活胶水在炎症肠道中被特异激活、在健康宿主中更快清除,体现出良好的安全性与转化潜力。
总结与展望
该研究提出并系统验证了一种以出血信号为触发的智能活体胶水平台,使工程微生物能够在病灶处自主定位、稳定停留并持续发挥治疗作用。该体系在急性与慢性两种IBD模型中均展现出一致疗效,并通过在体成像、功能评估和机制分析等多层证据支撑其科学合理性。在转化层面,研究团队进一步评估了免疫相容性并引入多重生物安全策略,同时展示了口服递送的可行性,为未来临床应用奠定了基础。
专家点评
该研究在同行评审中获得积极评价,德国INM–莱布尼茨新材料研究所Wilfried Weber教授评价道:“这项研究从基因电路设计到最终组织学评估进行了全面而系统的验证,有望成为自调控工程活体治疗材料的典型范例,并为该领域后续发展建立标准”。此外,研究团队也受邀以Research Briefings在同期发表评述文章“A therapeutic glue that autonomously targets gut bleeding in inflammatory bowel disease”,分享了该研究背后的科学思路、关键突破及其在工程活体材料领域的潜在影响。
本研究由中国科学院深圳先进技术研究院定量合成生物学全国重点实验室、合成生物学研究所钟超研究员、安柏霖副研究员与深圳大学医学部黄鹏教授共同担任通讯作者,钟超课题组原科研助理葛昌浩与深圳大学江珊珊博士为共同第一作者。研究过程中,中国科学院深圳先进技术研究院定量合成生物学全国重点实验室、合成生物学研究所施小山研究员、黄术强研究员,上海科技大学刘一凡教授,深圳大学林静教授,以及上海交通大学医学院附属瑞金医院刘琰教授等给予了重要支持与专业指导。该研究得到国家重点研发计划、国家自然科学基金及深圳医学研究专项等项目的资助,并依托深圳合成生物研究重大科技基础设施顺利完成。
