Nat Commun|周佳海/古阳/张继文合作解析阿卡波糖水解酶Apg的催化机制,抗降解药物设计迎来新突破!
阿卡波糖是治疗2型糖尿病的一线药物,但其疗效常被肠道细菌中的“阿卡波糖杀手”——阿卡波糖糖苷水解酶(Apg)破坏。近日,中国科学院深圳先进技术研究院合成生物学研究所客座研究员/南京师范大学教授周佳海团队及其团队副研究员古阳,联合西北农林科技大学教授张继文团队等,在《Nature Communications》发表题为“Molecular insights of acarbose metabolization catalyzed by acarbose-preferred glucosidase”的最新研究成果,利用X射线晶体学、计算模拟和生化实验结合,深入解析了Apg水解阿卡波糖的精细分子机制(图1),为设计新一代抗降解、更高效的降糖药物提供了关键的结构蓝图。

文章上线截图
原文链接:https://doi.org/10.1038/s41467-025-62855-y
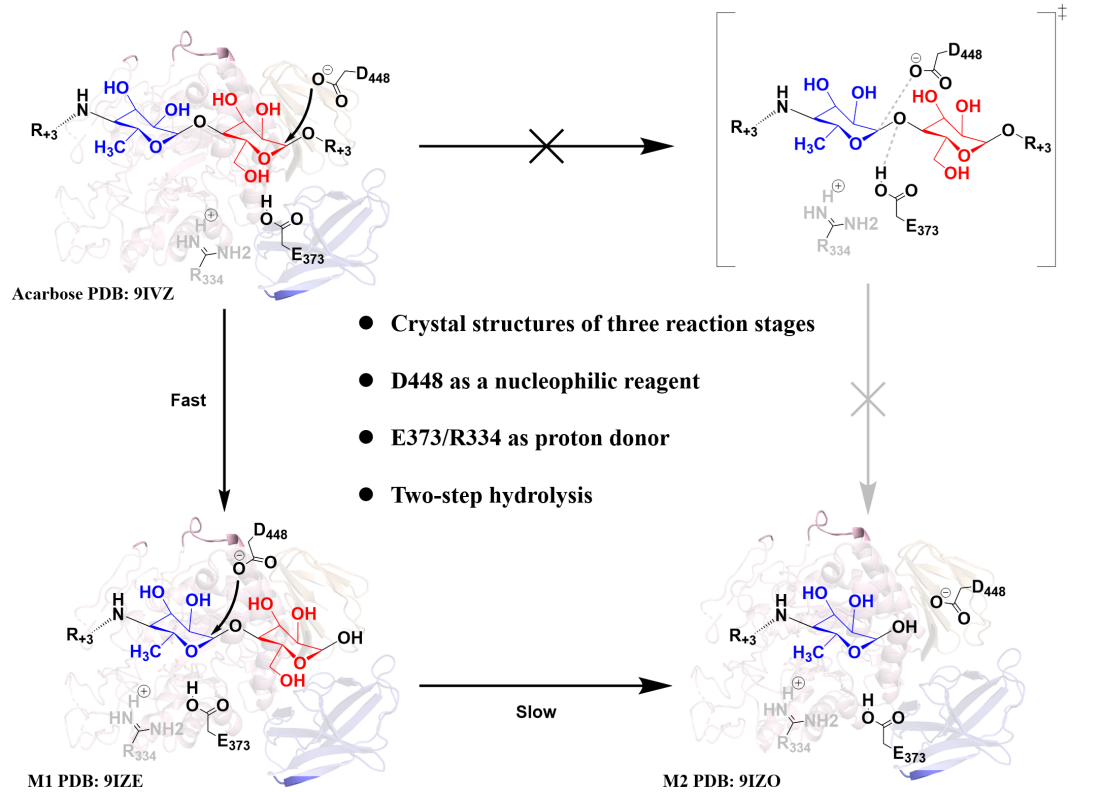
图1. Apg催化水解阿卡波糖的机制
一、阿卡波糖的困境:个体差异与耐药性
阿卡波糖作为一种“伪四糖”,主要通过抑制肠道α-葡萄糖苷酶延缓碳水化合物吸收来降糖。它具有全身副作用少的优点,但临床应用中存在显著的个体疗效差异和长期用药后的耐药性问题。近年中国科学院分子植物科学卓越创新中心姜卫红团队与合作者研究发现(Nat. Metab., 2023, s42255-023-00796-w),克雷伯氏菌属(K. grimontii TD1)中的Apg酶是导致阿卡波糖失效的关键“元凶”。它能高效降解阿卡波糖为acarviosine-glucose(M1)和acarviosine(M2),从而破坏其药效(图2)。然而,由于缺乏酶-底物/产物复合物的精确结构信息,导致该酶动态催化过程的分子机制仍不明晰,限制了糖尿病治疗的优化及抗糖尿病药开发。解析Apg独特的催化机制将有助于抗糖尿病药物的设计。
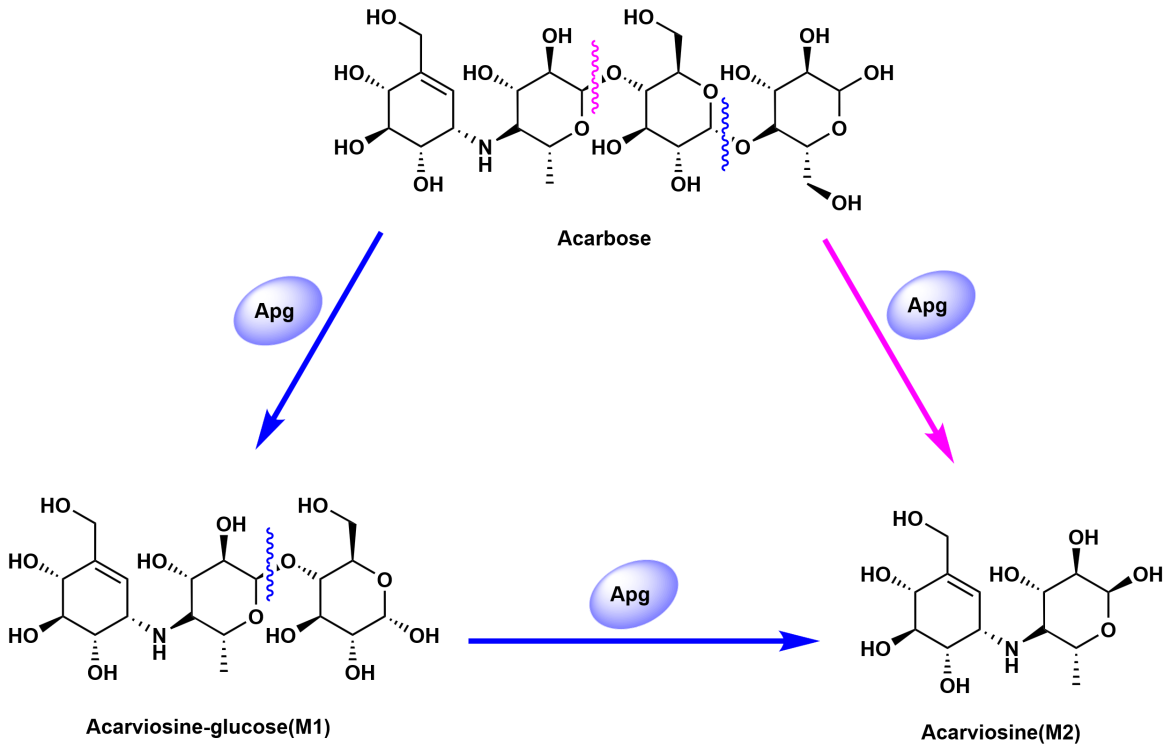
图 2. 由Apg介导的阿卡波糖降解途径
二、 锁定“杀手”:Apg的结构与特性
Apg属于糖苷水解酶家族13_21 (GH13_21),通常负责水解α-1,4-O-糖苷键。但其独特之处在于能有效水解结构复杂的阿卡波糖。研究解析了Apg的高分辨率晶体结构(图3):(1)Apg在溶液中以同源二聚体形式存在,单体间通过N端结构域和催化结构域呈头尾排列。(2)催化结构域采用经典的TIM桶折叠,活性位点是位于TIM桶顶部的一个突出表面凹槽,凹槽底部有一个绝对保守的催化三联体(Asp-Glu-Asp)。(3)与其他淀粉酶(如MaIZ, MaIS)相比,Apg的活性口袋裂隙更窄(7.9 Å),能紧密结合阿卡波糖,计算也显示其对阿卡波糖的结合亲和力更高。(4)结合生化实验、晶体结构和计算分析,发现两个关键的柔性环(loop A和loop B)不仅影响底物结合还决定其催化能力。
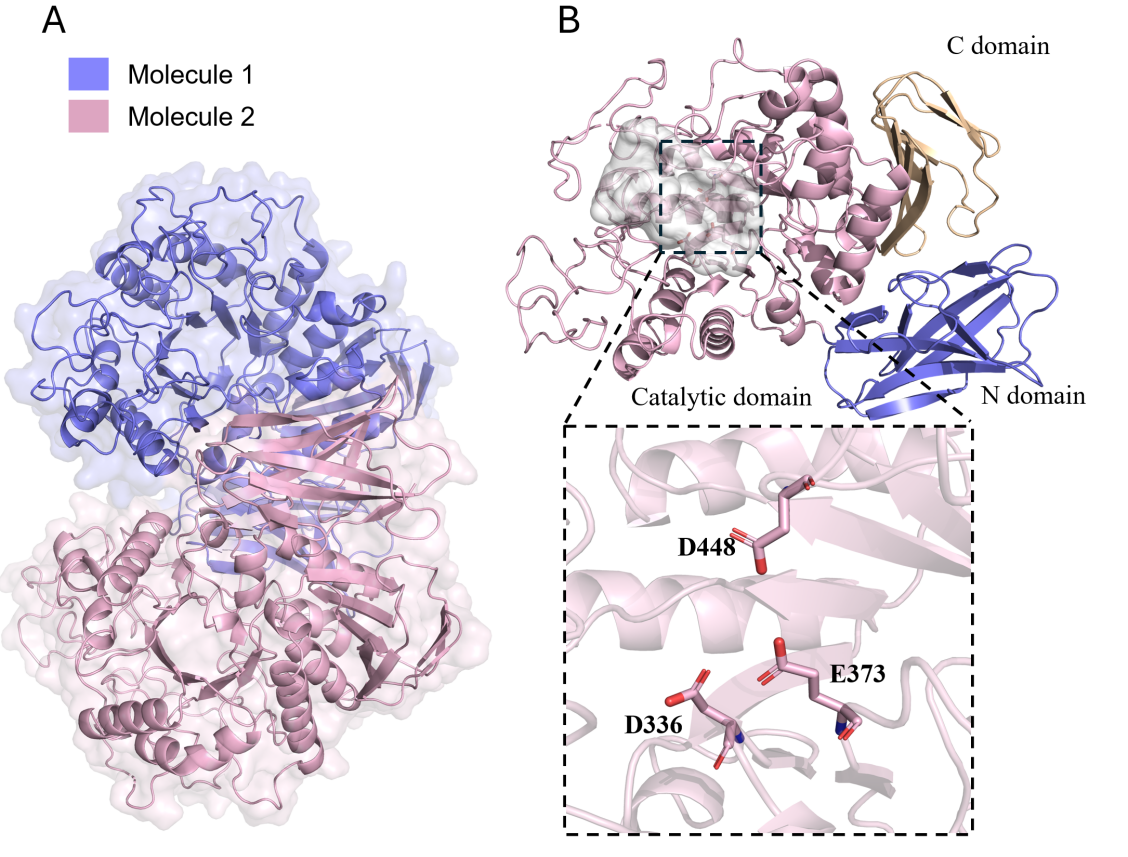
图 3. Apg的总体结构示意图
三、 重要发现:Apg催化机制的关键角色
通过分析Apg与阿卡波糖及其水解产物(M1, M2)的复合物晶体结构,结合定点突变和计算模拟(QM/MM, MD)(图4),研究揭示了催化机制的核心要素,并推翻了之前的假设:
- 真正的“攻击手”——亲核试剂:以往认为D336是亲核试剂,但本研究确凿证明D448才是关键的亲核试剂。首先,定点突变显示D448N变体完全丧失催化活性。其次,D448N突变体能紧密结合阿卡波糖,其复合物结构显示D448N的羧基氧(OD2)距离阿卡波糖被攻击的C1原子(4.2 Å)比D336的羧基氧(5.0 Å)更近。同时,密度泛函理论(DFT)计算显示D448 OD2携带更强的负电荷(-0.49 vs D336的-0.12),亲核性更强。进一步的 QM/MM计算证明D448作为亲核试剂的能垒(17.1 kcal/mol)远低于D336(26.7 kcal/mol)。最后,D448E突变能部分恢复活性(15%),支持其羧酸侧链直接参与催化。
- 双“供水者”——质子供体:除了之前已知的E373作为质子供体外,还揭示R334也是重要的质子供体。定点突变显示,E373A和E373Q突变保留部分活性,暗示存在其他质子供体。双重突变E373A/R334A导致活性完全丧失,证明R334是关键的替代质子供体。进一步的QM/MM结果支持R334作为质子供体,其反应能垒略高于E373。
- “稳定器”——D336:D336A突变保留了约48%的活性,其复合物结构显示它主要通过与底物形成氢键来稳定过渡态或底物构象,而非直接作为亲核试剂。
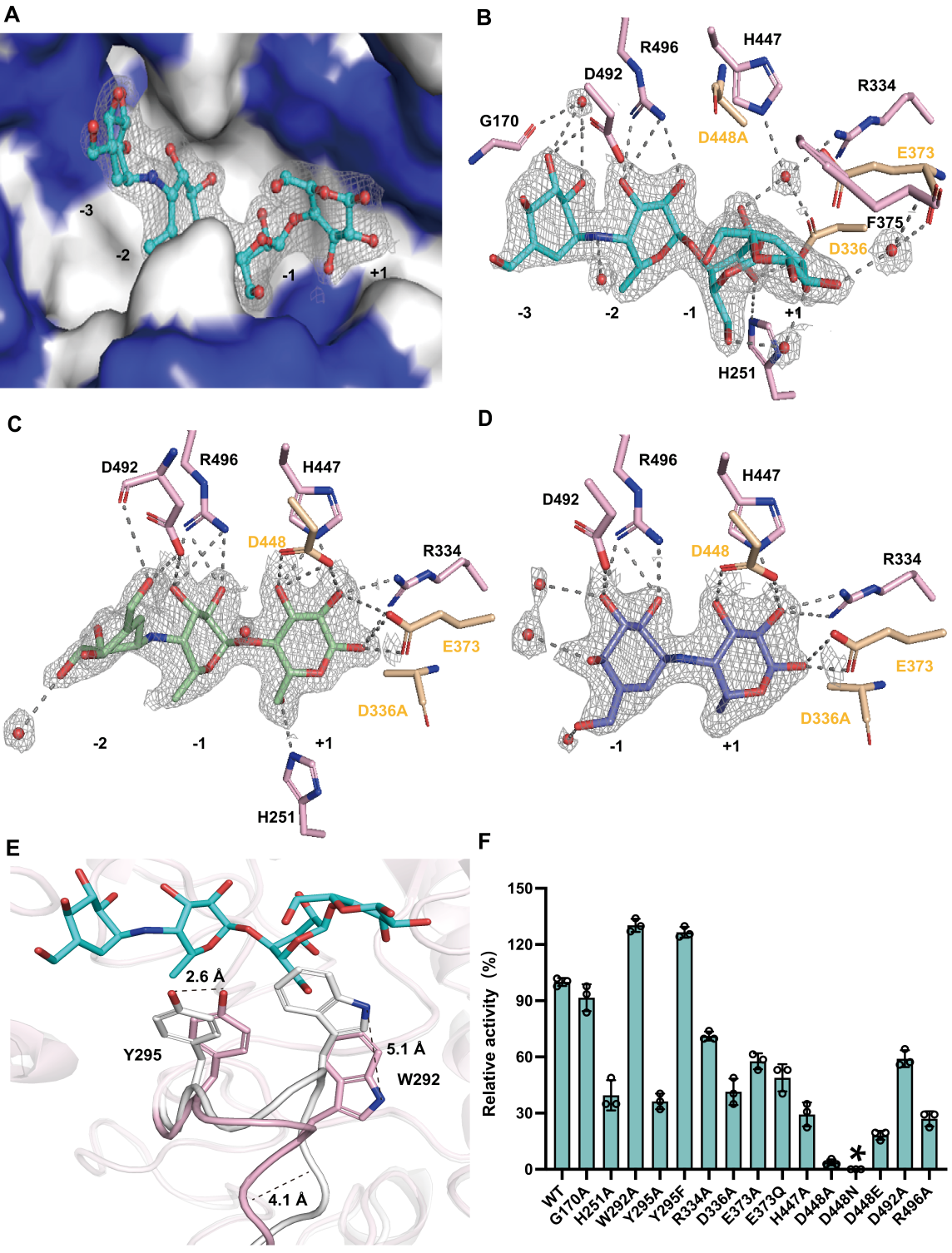
图 4 Apg 的复合物结构及突变酶活分析。(A)Apg 活性位点腔内底物阿卡波糖的示意图。(B)Apg(D448A)-阿卡波糖的复合物结构(PDB ID:9IVZ)。(C)Apg(D336A)-M1的复合物结构(PDB ID:9IZE)。(D)Apg(D336A)-M2 的复合物结构(PDB ID:9IZO)。(E)Apg(D448A)-阿卡波糖复合物(PDB ID:9IVZ)(残基为粉色)与突变体 Apg(D448A)(PDB 编号:9IXH)的结构叠加(残基为白色)。(F)Apg 活性位点上残基的诱变实验。
四、 水解路径揭秘:两步反应,一步限速
阿卡波糖被Apg水解的最终产物是二环的M2。关于M2是如何产生的,存在疑问:(1)是阿卡波糖直接一步水解成M2和麦芽糖?计算模拟(QM/MM)显示此路径能垒极高(36.9 kcal/mol),且实验中未检测到麦芽糖副产物,排除了此可能性。(2)还是分步水解?晶体实验观察到将Apg与中间产物M1孵育可生成M2。结合动力学和热力学分析发现,Apg对阿卡波糖的亲和力远高于对M1。进一步的自由能计算发现,Apg-阿卡波糖复合物的结合自由能(-20.5 kcal/mol)显著低于Apg-M1(-13.8 kcal/mol)。QM/MM计算显示,从M1水解到M2的能垒(19.7 kcal/mol)高于从阿卡波糖水解到M1的能垒(17.1 kcal/mol)。因此,阿卡波糖被Apg水解是一个明确的两步过程:第一步为阿卡波糖→M1+葡萄糖(相对较快),第二步为M1→M2+葡萄糖(此步是限速步骤,较慢)。
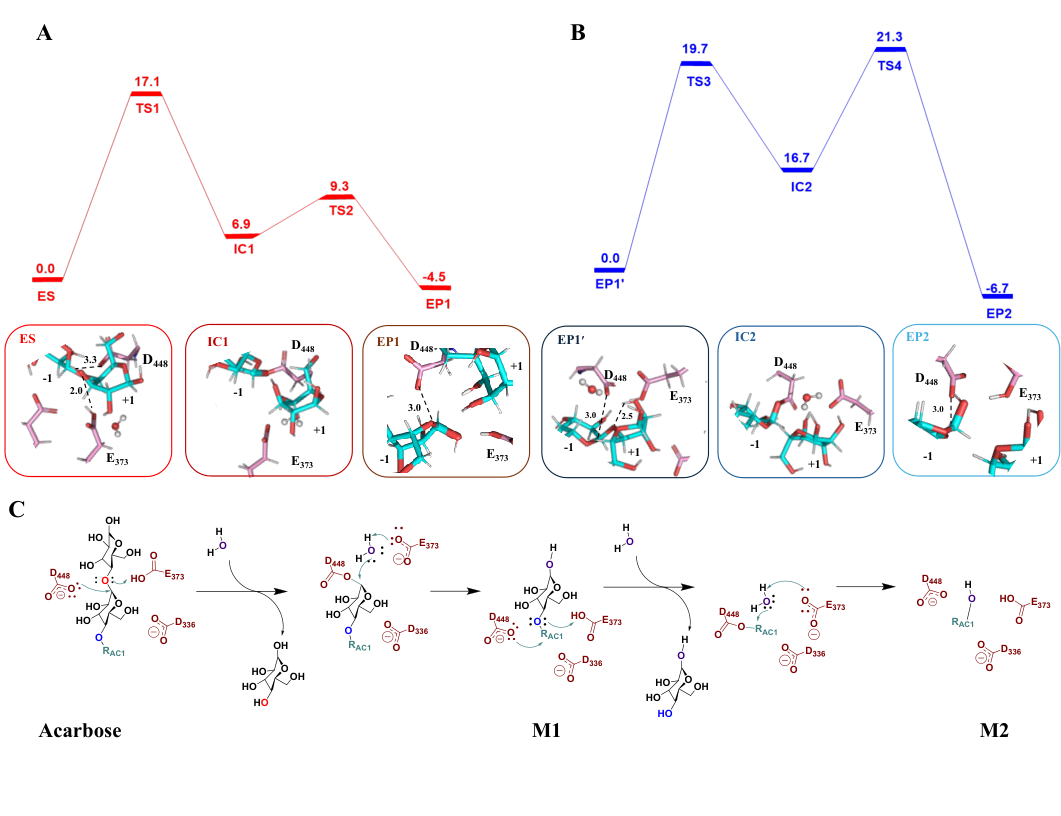
图 5. Apg催化阿卡波糖水解反应的两步过程
五、耐药类似物的启示:结构差异决定命运
研究还利用解析的Apg结构,对已知对Apg具有抗性的阿卡波糖类似物——acarstatins A和acarstatins B进行了计算分析。分子动力学模拟显示,它们也能结合在Apg活性腔内。但关键差异在于,它们分子中水解位点C1原子与亲核试剂D448 OD2的距离比阿卡波糖中的距离更远,使得D448难以有效攻击其糖苷键。进一步的QM/MM计算证实,水解acarstatinsA/B的活化能垒高于阿卡波糖。这为设计抗Apg降解的新药提供了直接线索:通过修饰改变底物关键原子与催化残基(特别是D448)的空间距离或相互作用。
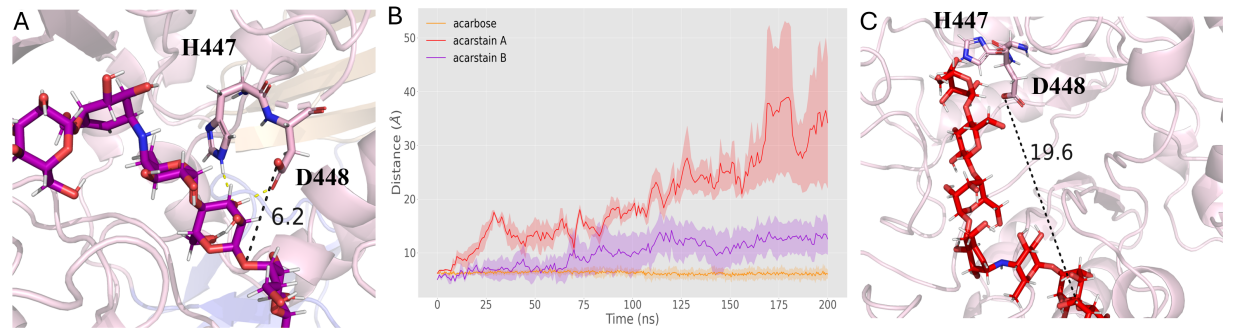
图 6. Apg-acarstatins A/B复合物的距离特征分析
综上,本文通过晶体结构解析、生化实验以及理论计算对Apg催化阿卡波糖水解反应机理进行了深入研究。揭示了Apg水解阿卡波糖的真实分子机制(D448为亲核试剂,E373/R334为质子供体,D336为稳定剂,两步水解且第二步限速),为糖尿病药物的设计与开发提供结构方面的见解,包括延长糖链的长度以增强其对抗Apg水解的能力,或者对阿卡波糖的结构部分进行选择性修饰以降低其结合亲和力。基于以上结构见解,对下一代阿卡波糖类似物的研究正在进行中。
本文的通讯作者为中国科学院深圳先进技术研究院合成生物学研究所客座研究员/南京师范大学教授周佳海、团队副研究员古阳,以及西北农林科技大学教授张继文。第一作者为中国科学院深圳先进技术研究院与西北农林科技大学联合培养已毕业博士研究生黄嘉咏。中国科学院深圳先进技术研究院助理研究员谌庄琳博士对于理论计算部分做出了重要贡献。感谢中国科学院深圳先进技术研究院助理研究员王兰腾博士在晶体解析方面的付出。感谢中国科学院深圳先进技术研究院与中国农业大学联合培养已毕业硕士研究生肖小云的付出。该工作受到广东省科技计划项目、国家自然科学基金项目、深圳市科技计划项目以及深圳合成生物学创新研究院等项目的资助。衷心感谢上海光源和国家蛋白质科学研究(上海)设施生物大分子晶体学线站BL18U1、BL19U1工作人员在数据收集方面的大力协助!
