JACS | 江寅迪团队揭示利血平生物合成过程中立体化学控制的酶学基础
利血平是一个具有里程碑意义的天然产物,自1952年从印度蛇根木中分离以来,深刻影响了我们对神经递质生物学和心血管医学的理解。作为经典的降压药物,利血平复杂的结构特征,包括独特的C3β构型和五个连续的手性中心,激发了包括R. B. Woodward在内的数代合成化学家开发创新合成策略。然而,自然界中利血平生物合成的立体化学控制机制一直未被揭示。
近日,中国科学院深圳先进技术研究院江寅迪课题组在国际期刊Journal of the American Chemical Society上发表了题为"Enzymatic Basis of Stereochemical Control in Reserpine Biosynthesis"的最新研究成果,首次阐明了利血平生物合成过程中立体化学控制的酶学基础。

文章上线截图
(文章链接:https://pubs.acs.org/doi/10.1021/jacs.5c02863)
利血平属于单萜吲哚生物碱大类,这一类天然产物包括著名的抗癌药物长春碱、喜树碱等,但它们在C3号位具有显著的结构差异。与其他已解析合成途径的单萜吲哚生物碱不同,利血平具有独特的C3β构型,这使其成为合成化学的经典挑战。早在1960年,研究者通过同位素示踪实验初步探索了利血平的生物合成,确认色胺是利血平的合成前体,但受限于当时的技术条件,对于自然界如何精准控制利血平C3β构型和五个连续手性中心的构建,仍然是个谜。
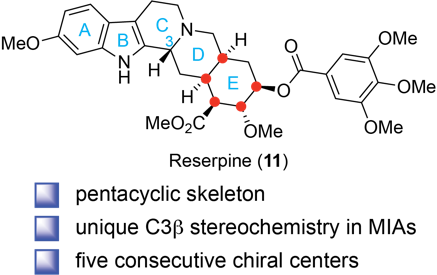
图1. 利血平的化学结构特征
破解C3β构型之谜
研究团队首先通过萝芙木(Rauvolfia verticillata)转录组分析,确定了常见的单萜吲哚生物碱生物合成中间体异胡豆苷(1)是利血平合成的关键中间体。在此基础上,他们鉴定出实现构型翻转的关键酶系统。团队从萝芙木中鉴定出关键的黄素依赖性氧化酶RvYOO和NADPH依赖性还原酶RvDYR1。RvYOO能够将具有C3α构型的α-育亨宾(2)氧化生成亚胺中间体3,随后RvDYR1立体专一性地还原这个中间体,最终生成具有C3β构型的3-表-α-育亨宾(4)。
五个手性中心的构建策略
为了解析五个连续手性中心的形成机制,研究团队系统分析了每个催化步骤。他们发现,前两个手性中心直接来源于底物马钱子苷,第三和第四个手性中心通过中链脱氢还原酶RvYOS的立体选择性还原建立。最关键的第五个手性中心由细胞色素P450单加氧酶RvCYP71D820催化的C18羟基化反应确立。
后期甲氧基化
与传统化学合成在早期引入甲氧基不同,研究团队发现自然界采用了独特的后期修饰策略。P450酶RvCYP72A270首先催化C11羟基化,随后O-甲基转移酶Rv11OMT完成甲基化修饰。这种后期官能团化策略体现了生物合成与化学合成的本质差异。
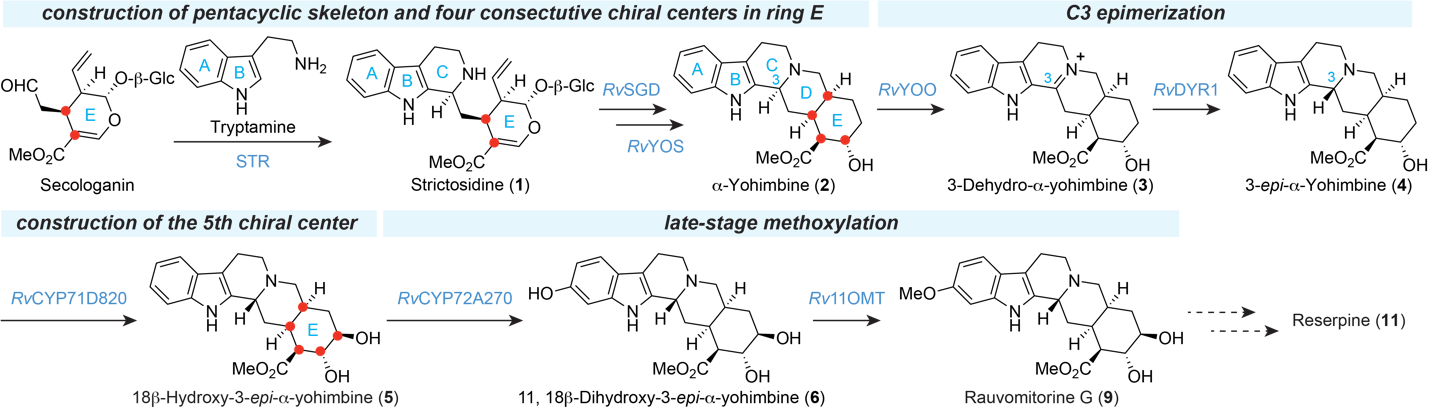
图2. 本研究解析的利血平生物合成途径
这项研究首次阐明了利血平生物合成中立体化学控制的酶学基础,解决了该领域长期存在的科学难题。发现的构型翻转机制在产单萜吲哚生物碱的植物中具有普遍性,为理解复杂天然产物的立体化学控制提供了重要范例。更重要的是,鉴定的酶学工具为代谢工程生产利血平及相关药物化合物奠定了基础,有望通过合成生物学方法实现这些重要药物的可持续生产。
中国科学院深圳先进技术研究院江寅迪研究员为论文通讯作者,江寅迪课题组助理研究员曹佳青为文章第一作者。该研究得到国家重点研发计划、深圳市科技重大专项以及深圳合成生物学创新研究院等多个项目的支持。
