Current Opinion in Systems Biology | DNA与基因组合成的最新进展
近日,中国科学院深圳先进技术研究院合成生物学研究所马英新研究员联合中国农业科学院深圳农业基因组研究所戴俊彪研究员在学术期刊《Current Opinion in Systems Biology》上发表题为“Recent development on DNA & genome synthesis”的综述。
文章回顾了DNA合成方法与合成基因组的发展历程,介绍了近几年来DNA酶法合成与合成基因组相关工作与应用,并讨论了该领域目前遇到的瓶颈与未来发展方向。文章旨在为生命科学领域的研究同行们介绍DNA合成与基因组合成领域的现状与最新进展,促进相关领域的交流与合作。深圳先进院博士生俞文斐为第一作者,深圳先进院马英新研究员与深圳农业基因组所戴俊彪研究员为文章的共同通讯作者。

文章上线截图
文章链接:https://doi.org/10.1016/j.coisb.2023.100490
历经数十年的发展,DNA的合成、组装和测序技术目前已达较高水平,研究者们可以快捷、低成本地获得合成寡核苷酸以及基因片段。合成DNA已被广泛应用于研究、诊断和治疗等领域,其重要应用之一则是构建合成型基因组。合成基因组学不仅实现了创造人造生命的梦想,还可加深研究人员对生命的理解,也为天然、非天然产物的生产提供了更好的底盘细胞。在过去的二十年中,合成基因组的大小、复杂程度不断提高,目标生物已涵盖病毒、细菌和酵母,并逐渐向高等真核生物发展。然而,随着基因组的长度从数千碱基(Kb)到数兆碱基(Mb),相应合成基因组项目的经济与时间成本也急剧增加。目前商业化的DNA化学合成方法的成本和速度已接近极限,成为了制约合成基因组学发展的主要因素之一,因此需要发展新一代的DNA合成技术与合成仪以解决该问题。文章主要介绍了 DNA 和基因组合成领域的最新进展,并且讨论了这两个领域亟待解决的问题与挑战。
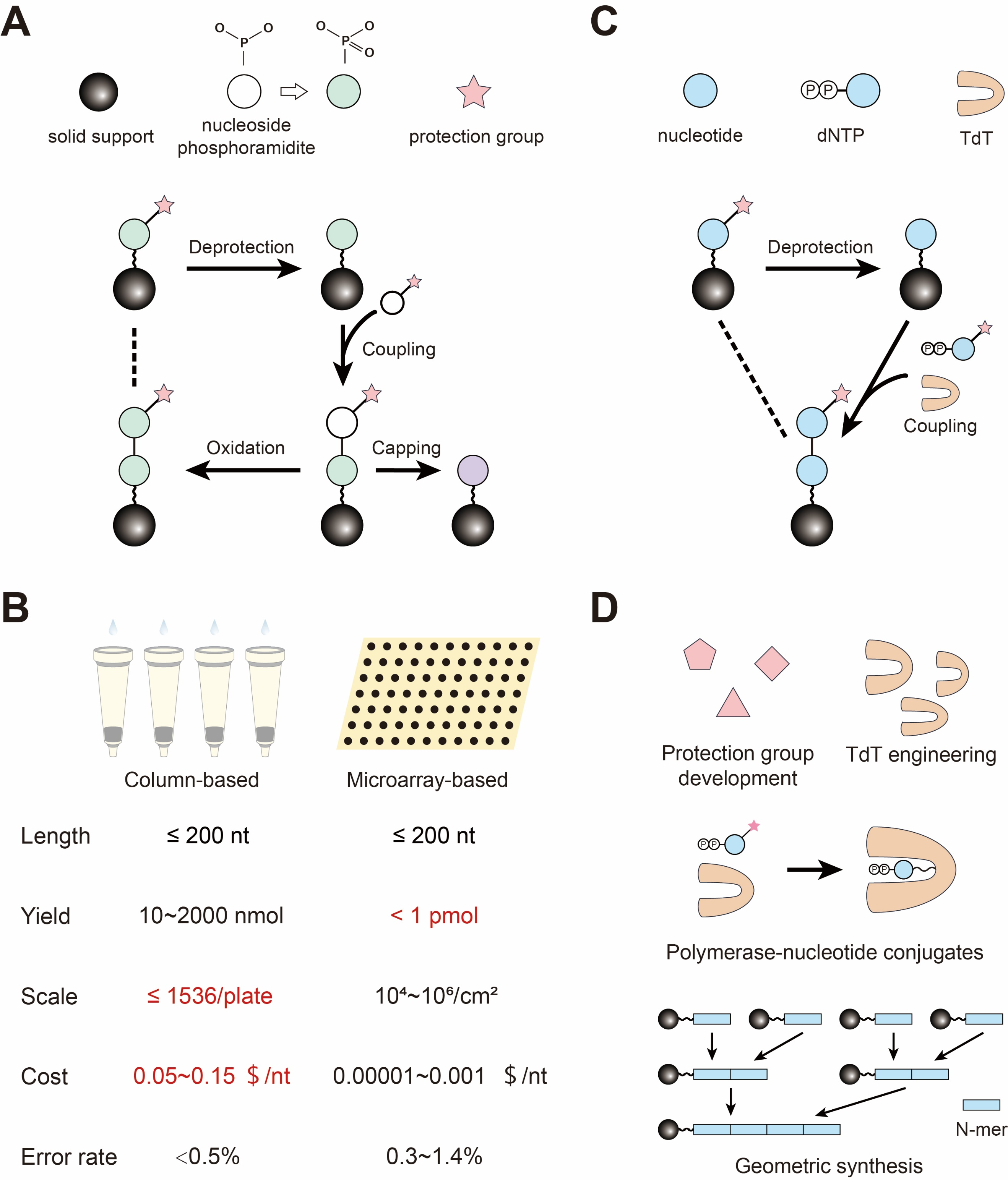
图1 DNA从头合成方法总览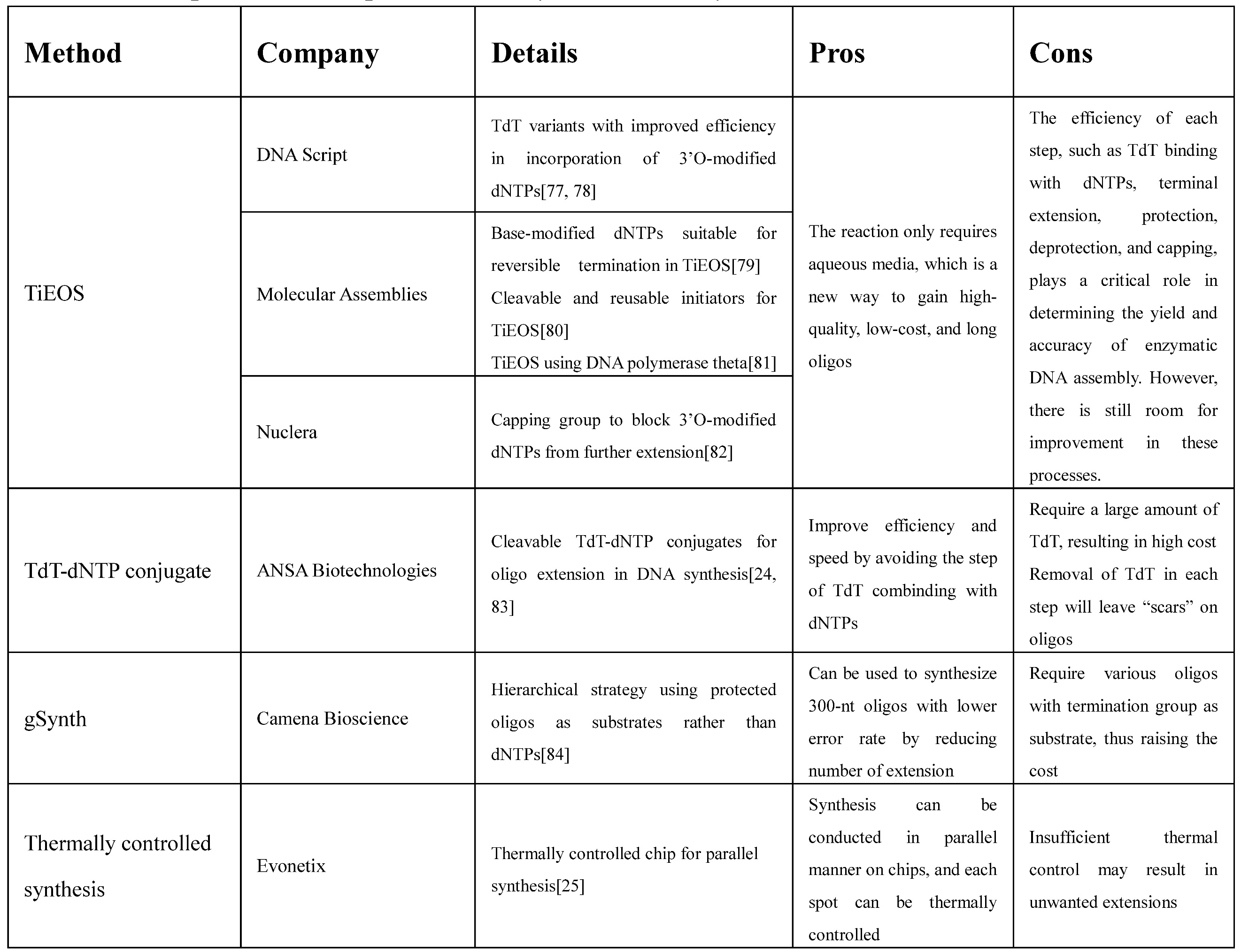
表1 主流DNA酶法合成策略
区别于传统的DNA化学合成法,DNA的酶法合成主要通过末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase, TdT)将dNTP整合至寡核苷酸链末端,以实现DNA单链的从头合成。DNA酶法合成无需大量有毒有害试剂,反应条件温和,且在体外可实现较长单链的延伸。然而该方法目前还面临诸多挑战,例如:天然的TdT整合修饰的dNTP的效率较低;天然酶的稳定性较差,对反应条件要求较高;寡核苷酸链末端在温和条件下易形成二级结构,降低了酶延伸的效率。
近年来,研究者们为DNA酶法合成策略进行了大量优化,包括TdT的筛选与改造,dNTP修饰基团的开发,TdT-dNTP共价连接法,寡核苷酸层级连接法,热控制芯片DNA合成法等。研究思路主要包括:筛选天然TdT或建立TdT突变库获取更适用于体外合成的酶;调整反应体系以减少二级结构的形成;调整酶反应过程以提高效率;开发平行合成策略以提高合成通量;优化寡核苷酸连接策略以减少反应次数等。目前已有多家生物公司致力于开发和优化DNA酶法合成策略,但鲜有实际应用的合成平台,仍需进一步的发展。
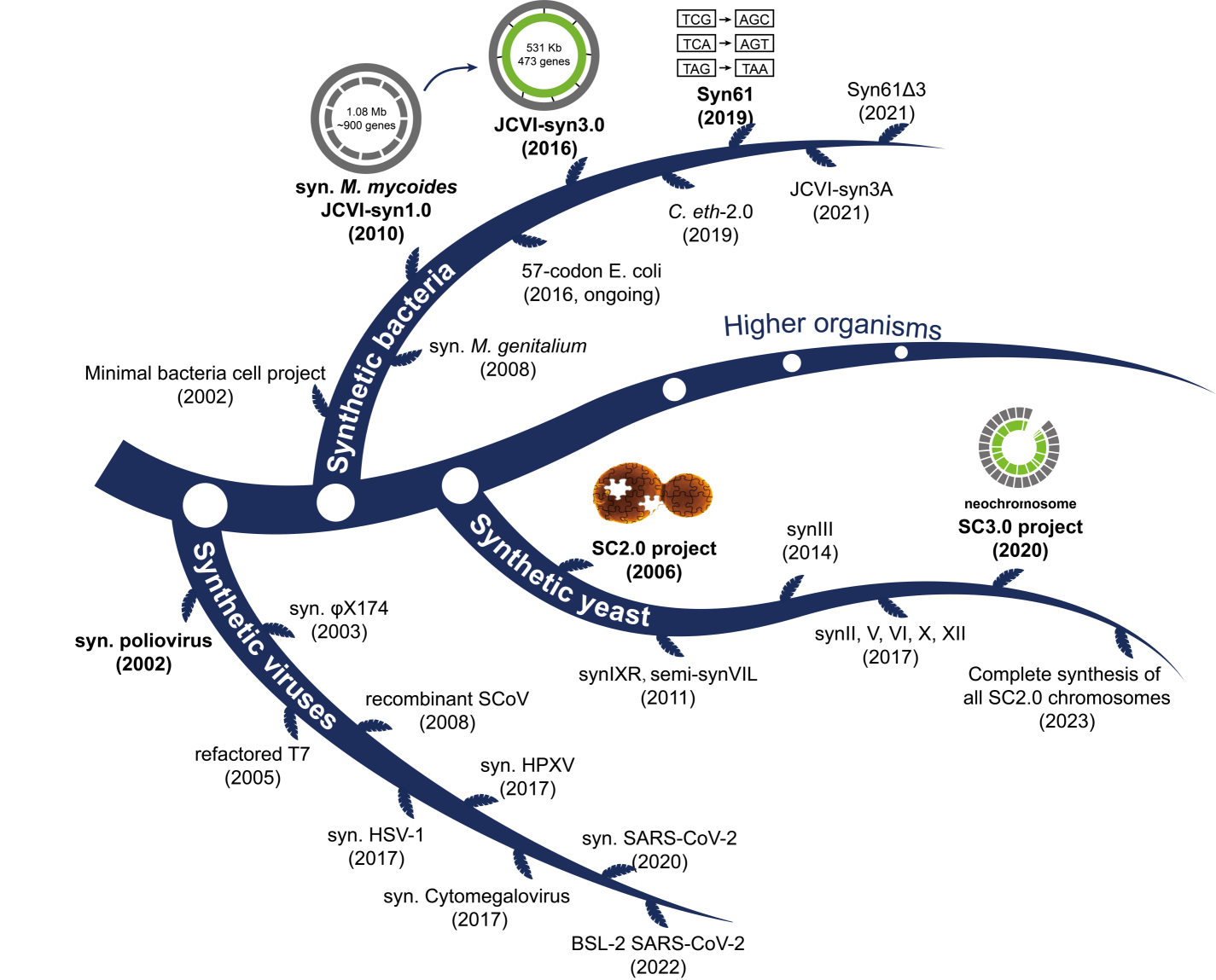
图2 合成基因组发展总览
从头创建人工生命体一直是合成生物学的一个重要目标。自第一个完整的脊髓灰质炎病毒cDNA成功构建的20年来,许多物种的基因组合成已被报道,包括病毒、细菌、酵母,甚至高等真核生物。近年来被合成的病毒包括单纯疱疹病毒、马痘病毒、新冠病毒等。从头合成的病毒可用于疫苗生产等,并且可以通过设计与拆分病毒基因组从而提高生物安全性。
目前,合成型的原核生物主要包括支原体和大肠杆菌。J. Craig Venter 团队早在2006年便提出了构建最小基因组的计划,他们的目标是通过设计、合成及转移微生物基因组以获得一个完全由合成序列控制的最简细胞。2016年,该团队通过设计改造覃状支原体,成功将其基因组大小缩减至一半,获得了目前世界上已知所含最小基因组的细胞JCVI-syn3.0。研究者们对最小基因组的生命活动过程,包括形态、生长、遗传信息转递、进化等进行了大量表征,多角度揭示了基因组组成对细胞基础生命过程的影响。对于大肠杆菌的合成基因组学研究主要集中在密码子的简化。起初,George Church团队尝试将大肠杆菌的密码子由64个缩减为57个,但测试发现部分基因进行密码子替换后无法发挥功能。2019年,Jason Chin团队成功合成了仅有61个密码子的大肠杆菌Syn61。通过移除相应的tRNA基因,该菌株可获得一定的噬菌体抗性,且可用于生产含非天然氨基酸的蛋白质。随后,George Church与Jason Chin利用了该合成型大肠杆菌构建了防止噬菌体侵染、菌株污染和基因水平转移等系统,为工业生产及生物安全防护提供了全新的基础和思路。
Sc2.0是由Jef D. Boeke教授领导全球多个团队开展的合成基因组计划。该计划对酿酒酵母基因组进行了大量修饰,包括统一端粒,去除转座子、内含子,替换终止密码子TAG,转移tRNA至新染色体以及引入大量loxPsym序列等。近日,全部16条染色体以及tRNA新染色体的合成均已完成,且包含6.5条合成型染色体的酵母菌株也已成功获取,标志着Sc2.0项目的里程碑式进展。目前,微生物合成基因组已取得极大进展,然而多细胞生物的基因组合成仍处于技术开发阶段。
在过去的几十年里,DNA合成技术极大地加速了生物学研究的进展,使得从头构建整个基因组成为可能。良好设计、构建的合成基因组可广泛应用于基础研究、疫苗开发、有价值的化学品和非标准氨基酸蛋白的生产等。然而目前合成基因组相关工作仍非常有限,主要是由于DNA合成成本较高、基因组构建周期长,并且缺乏通用的基因组转移技术等。由于研究人员对基因组的了解有限,较为激进的设计可能无法获得具有功能的基因组,但对现有基因组进行微小改进可能也并不会被视为重要工作。为了促进合成基因组的快速发展,需要解决以下问题。首先,基于微阵列的DNA合成技术的发展有望进一步降低DNA合成的价格,但从长远来看,酶法合成将是获取低成本、高质量、长寡核苷酸的更优选择。 其次,DNA大片段的组装通常依赖于大肠杆菌和酿酒酵母,可能需要较长时间进行变异检测和修复,因此需要开发染色体级大片段DNA的体外组装方法。 第三,不同物种通常不能使用相同的基因组移植方法,因此也需要进行新方法的开发。随着DNA合成和组装技术的发展,研究人员有望设计合成更高等生物体的基因组,以此推动生命科学前沿的进一步拓展。
资助信息:
该工作获得了国家重点研发项目(2021YFA0910900)、国家自然科学基金(32150025,32222044)、深圳市科技计划(KQTD20180413181837372)、深圳市科技创新委员会(RCYX20210609103823046)、深圳市杰出人才培养基金、中国科学院青年创新促进会(2021359)及深圳合成生物学创新研究院的支持。
