

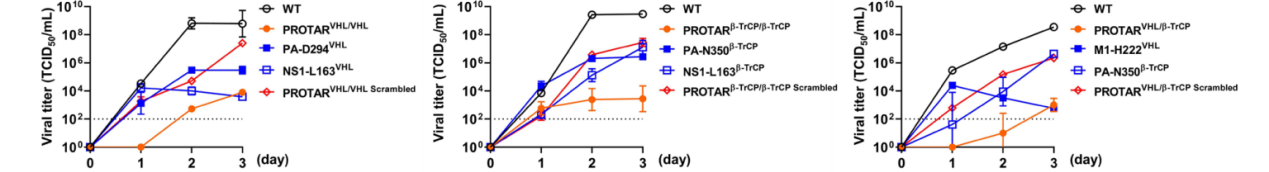
在本研究中,司龙龙团队利用宿主细胞的泛素-蛋白酶体系统可选择性降解靶蛋白的生物学机制,设计“生命开关”元件,工程病毒基因组,使得相应的病毒蛋白在正常细胞中会被泛素-蛋白酶体系统识别而降解,导致病毒复制能力减弱,将野生病毒转化成为蛋白降解靶向(Proteolysis-targeting, PROTAR)的潜在疫苗;为了实现PROTAR疫苗的高效制备,研究团队构建了泛素-蛋白酶体系统功能缺陷的工程细胞系,在该细胞系中“生命开关”元件介导病毒蛋白降解的功能失效,病毒蛋白稳定,使得PROTAR疫苗可以高效复制而大量制备(图1)。研究团队将这一技术命名为第二代PROTAR疫苗技术(PROTAR疫苗2.0)。与该团队2022年提出的第一代PROTAR疫苗技术(Nature Biotechnology 40, 1370–1377 (2022))仅允许“生命开关”元件装载在病毒蛋白两端(N端和C端)相比,PROTAR疫苗2.0支持“生命开关”元件装载在病毒蛋白的任意合适的位点,包括病毒蛋白两端和内部位点。这一技术改进,不仅为“生命开关”元件在病毒蛋白中的装载提供了大量位点选择空间,提高了技术灵活性和通用性;而且可以实现多个“生命开关”元件在同一病毒颗粒中的同时装载,提升了疫苗的安全性。

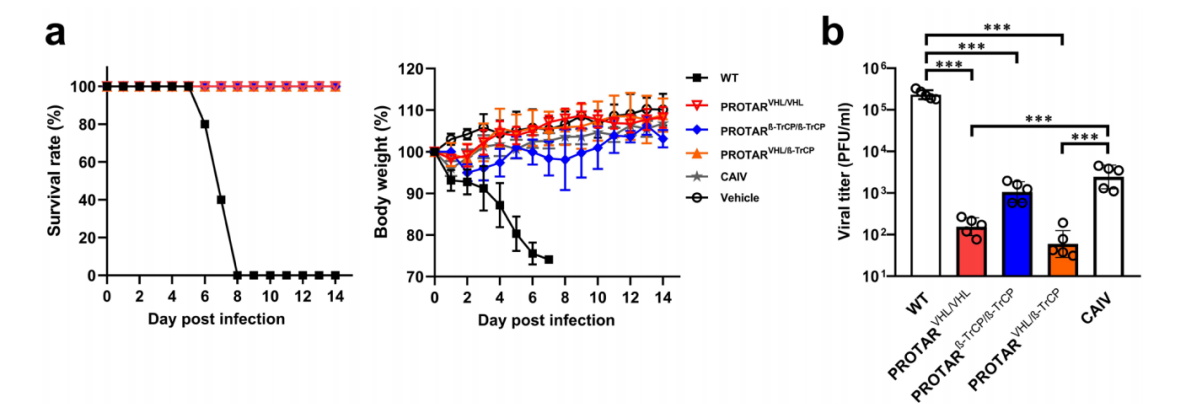
该团队在动物模型中,对PROTAR 2.0疫苗候选株进行了安全性评价。与野生型(WT)流感病毒相比,相同剂量的PROTAR 2.0疫苗候选株(PROTARVHL/VHL、PROTARβ-TrCP/β-TrCP、PROTARVHL/β-TrCP)均未引起小鼠死亡、体重减轻或任何其他疾病症状,说明了PROTAR 2.0毒株在小鼠模型中的安全性(图3)。
课题组招聘:本课题组长期招收分子生物学、细胞生物学、生物化学、药学、病毒、疫苗、免疫等研究背景的博士后、助理研究员。有意申请者请将个人简历(要求为PDF)发送至ll.si@siat.ac.cn,简历及邮件标题注明“应聘岗位-学校名称-专业-姓名”。
专家点评
高福,中国科学院院士、美国国家科学院和医学科学院外籍院士,病原微生物与免疫学家
司龙龙团队提出并建立了第一代“蛋白降解靶向(PROTAR)减毒活疫苗技术”新概念(Nature Biotechnology 40, 1370–1377 (2022)),利用细胞中E3泛素连接酶VHL操控流感病毒蛋白的降解,将野生型流感病毒转化成减毒活疫苗。在当前发表在Nature Microbiology期刊上的这项研究工作中,该团队基于第一代PROTAR减毒活疫苗技术,进一步挖掘利用细胞中E3泛素连接酶的多样性,大规模设计构建了依赖不同E3泛素连接酶降解的PROTAR流感减毒活疫苗株,建立了PROTAR流感减毒活疫苗库,系统研究了不同疫苗株的安全性、免疫原性、免疫保护效果。该工作极大丰富了PROTAR流感减毒活疫苗的多样性,支撑PROTAR活疫苗系统评价与优化,拓展了人们对PROTAR减毒活疫苗的认知,为 PROTAR疫苗技术的推广应用提供科学基础。同期,该团队在Nature Chemical Biology期刊发表研究成果,报道了第二代PROTAR疫苗技术(PROTAR疫苗2.0),与第一代PROTAR疫苗技术相比,PROTAR疫苗2.0版本打破了蛋白降解诱导元件设计位点单一的局限,可以在病毒多个蛋白多个位点上引入蛋白降解诱导元件,进一步提升疫苗安全性和技术的灵活通用性。该团队在PROTAR减毒活疫苗研发方向上的连续性工作为包括流感在内的多种流行性病毒的减毒活疫苗设计提供了新思路、新方法。
赵国屏,中国科学院院士、美国微生物科学院院士,分子微生物学家
合成生物学作为一门新兴的交叉学科,借鉴工程学原理,设计改造天然生物系统,或合成新的生物体系,揭示生命运行规律(造物致知),变革生物体系工程化应用(造物致用),在食品、医药、能源、环境、材料、农业等领域发挥着越来越重要的作用。
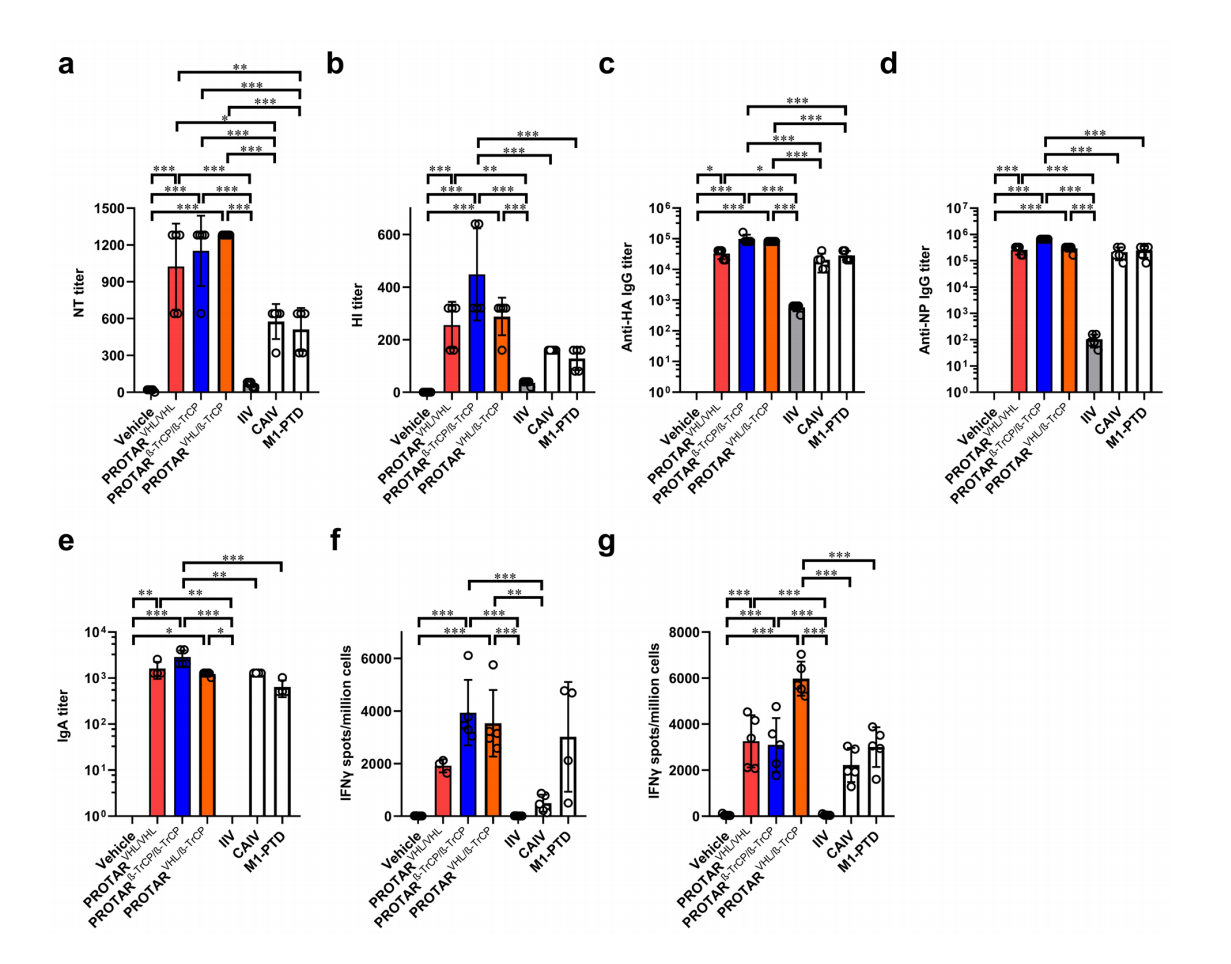
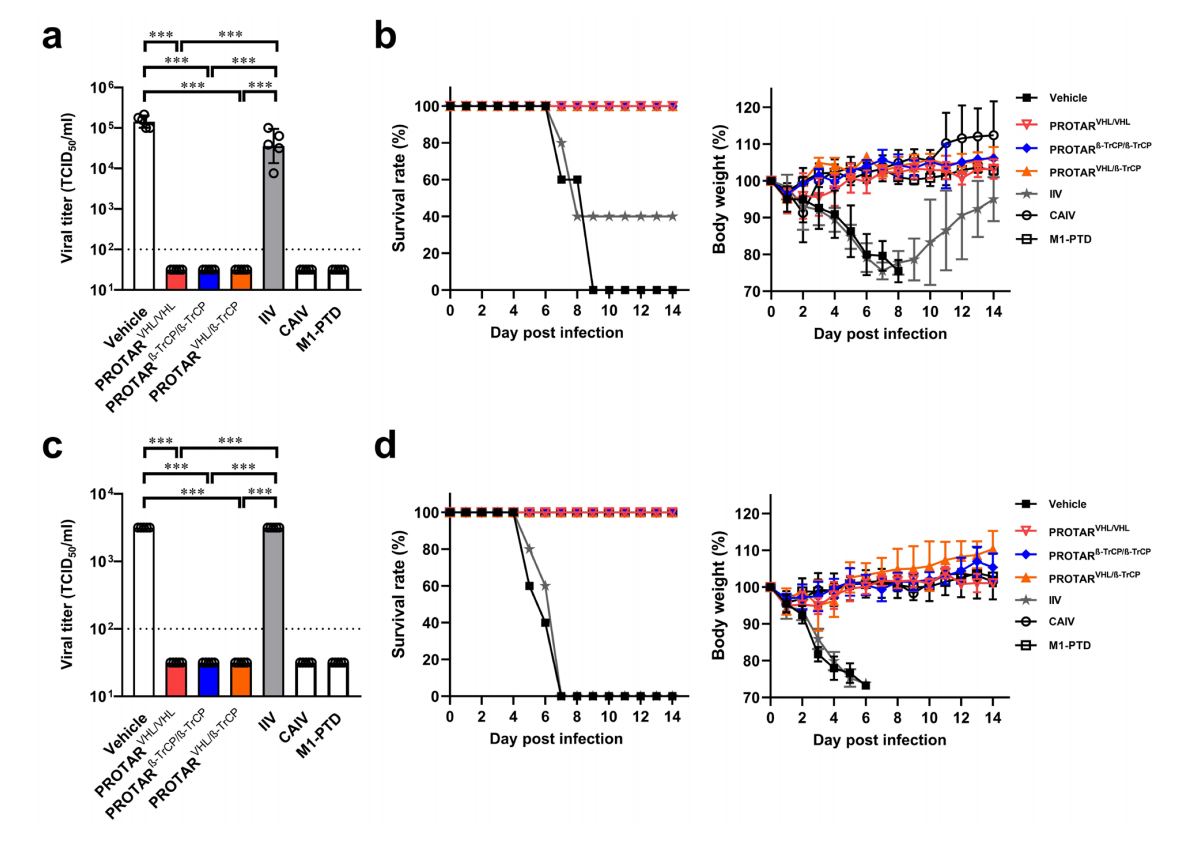
司龙龙团队运用合成生物学原理技术,以流感病毒为模型,在病毒蛋白上设计装载介导蛋白降解的E3泛素连接酶专一识别肽段,这样一种“生命开关元件”;此类被改造的病毒,虽然可以在能够将生命开关元件从病毒蛋白上移除或者E3失活的细胞中复制繁殖,但进入正常的宿主细胞后,植入“生命开关”的突变蛋白就会被E3靶向降解,进而控制病毒复制,成为减毒活疫苗。该团队将这一技术命名为蛋白降解靶向(PROTAR)疫苗技术,该疫苗技术最初由该团队于2022年提出(Nature Biotechnology 40, 1370–1377 (2022))。过去几年,该团队从“生命开关元件种类多样性”和“元件装载位点的多样性”两个维度,对PROTAR疫苗技术进行了优化迭代,相关成果同期分别发表在Nature Microbiology和Nature Chemical Biology期刊。在Nature Microbiology期刊成果中,该团队利用细胞内E3泛素连接酶的多样性,系统地设计和构建可以操控病毒蛋白靶向降解的生命开关元件,进而构建具有不同水平安全性和免疫原性的PROTAR疫苗株;通过系统地筛选和评价,可以获得安全可控和高效免疫兼备的PROTAR疫苗株。在Nature Chemical Biology期刊成果中,该团队拓展了元件装载位点的多样性,从原来只能在流感病毒单个蛋白(M1)的C端引入生命开关元件,拓展到可以在病毒多个蛋白的多个位点上引入多个不同的生命开关元件,这一优化使得同一疫苗株可以包含多个生命开关元件的组合,进一步提高安全性。
值得一提的是,不同个体/群体之间E3泛素连接酶的表达丰度和功能强度有可能存在差异,该团队建立的依赖不同种类E3泛素连接酶减毒的PROTAR流感疫苗库, 可以为不同个体/群体提供适合的PROTAR疫苗株,为流感疫苗在不同个体/群体中的个性化接种提供可行性。该工作基于合成生物学研发新型疫苗技术,丰富了人们对抗传染性疾病的武器库,是合成生物学推动生物医药发展的成功范例。
饶燏,清华大学药学院教授,国家级人才,靶向蛋白质降解技术开发与应用资深专家
泛素-蛋白酶体系统是细胞内天然存在的一种蛋白质降解机器,作为细胞内蛋白质降解的主要途径,参与细胞内80%以上蛋白质的降解,以维持细胞内蛋白质稳态。近年来,科研人员利用泛素-蛋白酶体系统可以降解蛋白的生物学功能,开发基于化学小分子的蛋白降解剂,用于治疗肿瘤等疾病,正逐渐成为新药研发领域的重要前沿。司龙龙团队开发的基于蛋白降解的PROTAR活疫苗技术,是泛素-蛋白酶体系统生物学机制在除化学小分子药物开发之外的又一创新应用和重要拓展,也为新型疫苗开发提供了全新策略。
该团队开发的PROTAR疫苗技术提供了一个简单易行的疫苗制备方法,通过基因工程手段,在病毒蛋白的合适位点引入可以被泛素-蛋白酶体系统识别的氨基酸序列(文中简称PTD),条件性“开”和“关”病毒蛋白降解,可以分别实现PROTAR疫苗减毒和制备;进一步优化PTD的序列和在蛋白中的位置,或者增加PTD的数量和种类,可以进一步增加PROTAR疫苗的安全性。此外,PROTAR疫苗方法在将病毒减毒、增加安全性的同时,还可以利用细胞中泛素-蛋白酶体系统的抗原递呈能力,增加疫苗抗原表位肽的递呈,从而在降低病毒复制、增加安全性的同时,可以保留甚至增强疫苗的免疫效果。该方法通过主动诱导和增加病毒抗原递呈,有助于新的病毒抗原肽的产生和发掘,拓宽人们对病毒的免疫学认知,促进相应的病毒防治策略的开发。PROTAR疫苗技术的另一重要特色是,它可以充分利用泛素-蛋白酶体系统中E3泛素连接酶的多样性、病毒蛋白种类和氨基酸位点的多样性,系统性地制备具有不同安全性和免疫原性的PROTAR病毒株,为最优PROTAR疫苗株的鉴定提供了可能。