团队之前提出“抗原场理论”并在新冠病毒中完成了验证,本工作旨在将“抗原场理论”拓展应用在流感病毒中,希望通过理论计算和建模以实现广谱疫苗的设计。

文章上线截图
(点击文末“阅读原文”直达文章链接)
初衷
甲型H5N1流感病毒自2022年以来引发了全球性的疫情,有可能引发大流行。现有的疫苗开发策略沿用甲型H3N2和H1N1流感疫苗策略,对新出现的病毒株效果不佳。实际上,H5N1的进化模式更类似于新冠病毒,而非H3N2和H1N1,因此需要针对其独特进化特征,采用新型的疫苗开发策略,如多抗原展示、抗原距离优化、AI技术等,以开发出广谱疫苗。
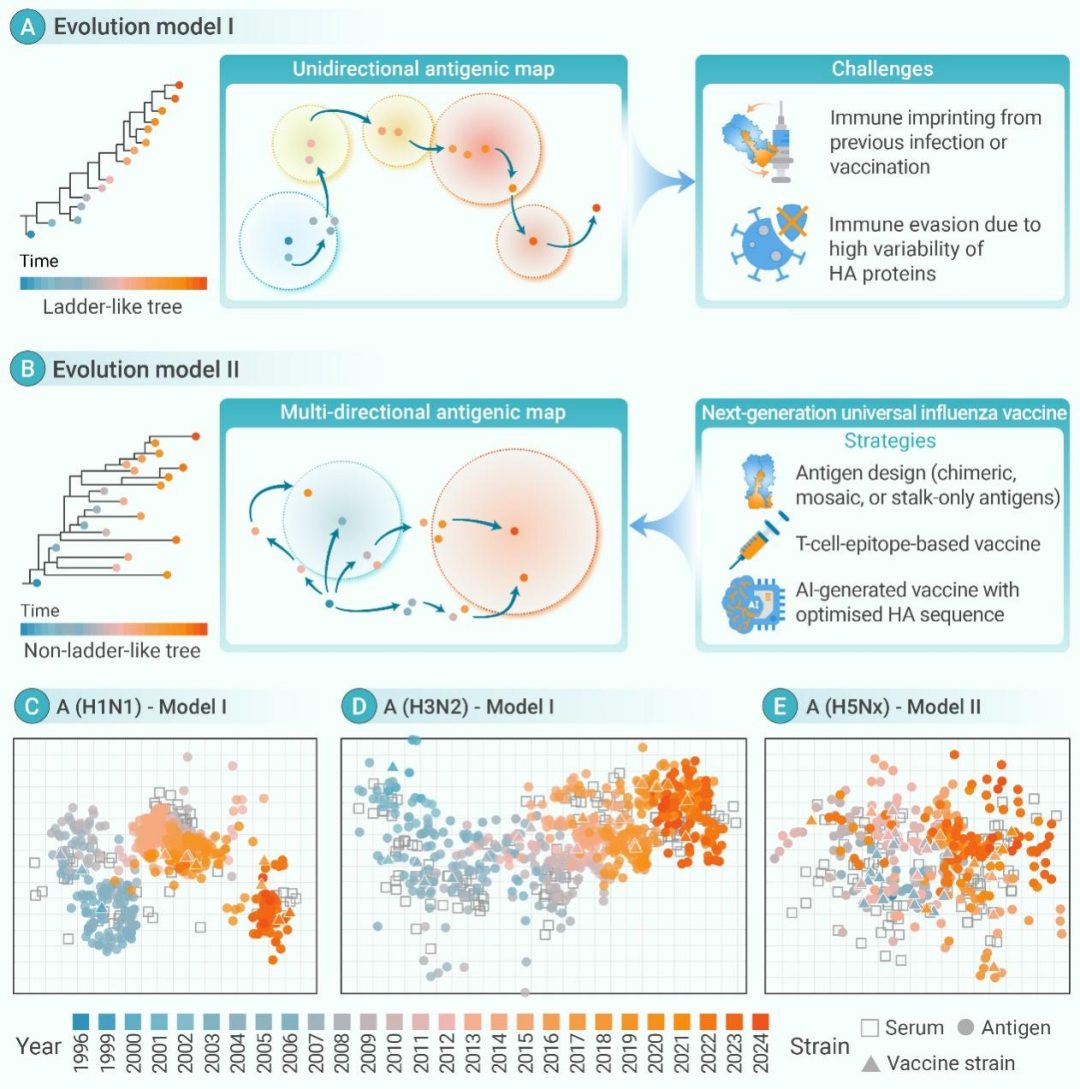
图 | 不同的病毒进化模式与疫苗设计策略
甲型H5N1流感病毒,特别是2.3.4.4b进化枝,已引发了多例动物传人感染甚至导致死亡病例。目前,FDA和EMA批准的疫苗主要针对其他进化枝,如A/Vietnam/1203/2004(进化枝1)、A/turkey/Turkey/1/2005(进化枝2.2.1)和A/Indonesia/5/2005(进化枝2.1.3.2)。然而,由于免疫逃逸,这些疫苗对新出现的病毒株(如A/Texas/37/2024)效果不佳,因此亟需开发新的疫苗。
传统流感疫苗(如甲型H3N2和甲型H1N1)的开发思路通常为“亦步亦趋”:世界卫生组织(WHO)会定期与各个合作中心和实验室的专家进行磋商,分析全球流感病毒数据,为下一个流感季节开发疫苗提供推荐流感病毒株,这种方式比较适合H1N1和H3N2。这一类流感病毒的进化模式(模式I)为:其进化树呈阶梯状,其抗原地图显示的抗原为单向间断进化,并按时间聚为若干类。这是由于季节性流感病毒的强免疫选择所导致的,新毒株的爆发将逐步替代现有毒株。在某一流感季中,优势毒株在人类中产生免疫选择,从而在下一个季节中“选择”出免疫逃逸的优势毒株,形成“阶梯状”的进化模式;H5N1流感病毒的进化模式(模式II)与H1N1和H3N2显著不同,其进化树呈非阶梯状,抗原图则为多向的。这种多向进化模式与新冠病毒(SARS-CoV-2)更为相似,这使得疫苗开发变得更加复杂。而“亦步亦趋”的策略——每季度更新疫苗种子株——难以完全追上这一进化模式的病毒。以研发速度最快的新冠疫苗为例,奥密克戎毒株(Omicron,B.1.1.529/BA.1)2021年11月爆发,针对BA.1毒株的疫苗在2022年2月启动2期临床试验,等到结果在2022年9月公布时,主流毒株已经变成了BA.5。这需要一种新的策略能够跑赢这一进化模式的病毒。
在复杂进化模式的基础上,流感病毒疫苗的设计需要同时考虑预存免疫和免疫逃逸现象。预存免疫可能引发反向增强效应,从而增强免疫效果,但也有可能由于免疫印迹效应而减弱免疫效果。此外,流感病毒的血凝素蛋白的免疫逃逸现象也会影响疫苗的设计。因此,针对H5N1的疫苗开发需要具备“料敌机先”,走在病毒进化之前,以减弱免疫印记效应,优化疫苗设计,提高疫苗的广谱保护效果。一种可能的策略是通过引入多种抗原,通过诱导可以同时中和多种抗原广谱抗体来增强疫苗的保护效果。例如,采用重组纳米颗粒或多价mRNA疫苗可以同时递送多种抗原,这种方法能够减弱免疫印记效应。同时,引入计算机模型也至关重要。我们用“抗原距离”用来衡量不同突变株的免疫逃逸程度,选择适当抗原距离的抗原以优化疫苗设计,可以最小化总体免疫逃逸程度,这也有助于减弱免疫印记效应并提高疫苗的广谱保护效果,这已经在新冠疫苗开发中进行了验证【Hu, et al. Cell Host & Microbe. 2023. 31(8):1301-1316.e8. doi: 10.1016/j.chom.2023.07.004.】。此外,未来的疫苗开发将愈加依赖于AI技术,通过大规模数据训练AI模型,一方面可以优化抗原序列【Zhang, et al. Nature. 2023. 621(7978):396-403. doi: 10.1038/s41586-023-06127-z.】,另一方面可以精确预测不同突变株的免疫逃逸程度【Taft, et al. Cell. 2022. 185(21):4008-4022.e14. doi: 10.1016/j.cell.2022.08.024】,从而设计出优化的抗原,进而自动设计出理想的通用疫苗,提高疫苗的广谱保护效果。
总结与展望
开发广谱保护的通用流感疫苗是应对未来流感大流行的关键,通过大规模免疫数据模型训练,AI技术将变革未来的疫苗开发策略。
本文内容来自Cell Press 合作期刊 The Innovation 第六卷第一期发表的 COMMENTARY 文章“Distinct evolution patterns of influenza viruses and implications for vaccine development” (投稿: 2024-08-08;接收: 2024-11-19;在线刊出: 2024-11-20)。
DOI:10.1016/j.xinn.2024.100739
引用格式:Hu Y., Zhang B., Chu H., et al. (2024). Distinct evolution patternsof influenza viruses and implications for vaccine development, The Innovation 6:100739.
作者简介
黄建东
教授,中国科学院深圳先进技术研究院合成生物学研究所客座研究员、香港大学医学院合成生物学讲座教授、慧贤慈善基金教授席(生物医学)。长期从事合成生物学的研究和应用,是华语世界率先开展合成生物学研究的学者及领军人物之一。科技部重点研发计划首席科学家。曾获美国NIH 杰出成就奖、裘槎优秀科研者奖、第十五届药明康德生命化学研究奖学者奖等荣誉。在Nature、Science、Nature Physics等国际权威期刊发表论文230余篇。https://www.sbms.hku.hk/staff/jiandong-huang
胡叶凡
博士,现任贝湾生物科技有限公司CEO。专注于合成免疫学基础研究,利用数理模型和AI进行免疫反应预测,提出了“抗原场”理论,以及进行肿瘤疫苗临床转化。在Cell Host & Microbe、Nature Communications、Cell Research等期刊发表多篇文章。在2024年参与国家自然基金委重大研究计划。
张宝中
博士,现任中国科学院深圳先进技术研究院副教授,长期从事多种耐药细菌及病毒的研究及相关,在病原体疫苗技术、挖掘细菌抗原与鉴定、抗原表位的分析与鉴定、抗病毒药物研发及人脑类器官病毒感染模型等方面有15年的积累。在Cell Host & Microbe、EBioMedicine、Nature Communications、Cell Research等期刊发表多篇文章,总引用>2000次,作为第一发明人或参与发明人申请国家、国际专利 8项,已授权3项。在2024年参与国家自然基金委重大研究计划。
朱轩
博士,现任香港大学新发传染病国家重点实验室及医学院微生物学系副教授、博士生导师、BSL3实验室生物安全主任。专注冠状病毒致病机制研究,发表论文160篇,H因子57,总引用>33,000次。在Nature、Lancet、Cell Host & Microbe、Nature Microbiology、Lancet Microbe、Cell Research、Nature Methods、Nature Biomedical Engineering等期刊发表论文 >60篇。2021、2022 及2023年连续被科睿唯安评为世界被引用数排名前 1% 的学者以及全球 “高被引科学家” (2023年全球238位双领域高被引科学家之一)。2021年获国家自然科学基金优秀青年科学基金(港澳)。https://www.mibpage.hku.hk/items/dr.-chu%2C-hin