
太阳能是典型的清洁能源,开发光能驱动的高价值化学品绿色合成途径,有助于促进社会可持续发展。半导体-微生物杂合体系(半人工光合系统)兼具半导体广谱光吸收特性和微生物催化高选择性等优点,有望实现将太阳能高效转化为多种化学能形式,近年来引起了广泛关注。目前研究人员普遍使用CdS、TiO2、量子点等半导体材料与微生物进行结合,但仍存在构建体系过程复杂、生物相容性较差、电荷传输效率低等缺陷,且材料-生物杂合界面的电子传递机理仍不清晰,需进一步探索以丰富其理论发展。近年来,卟啉基金属有机框架(Metal-Organic Framework, MOF)因其催化活性高、结构可调成为了重点研究对象,但是与其他半导体材料相比,其在半人工光合系统中作为捕光模块的应用仍较少,值得进一步探索研究。
2024年4月25日,中国科学院深圳先进技术研究院合成生物学研究所王博团队与广西大学资源环境与材料学院侯燕萍团队在Advanced Science 杂志合作发表了题为A Self-Assembled MOF-Escherichia Coli Hybrid System for Light-Driven Fuels and Valuable Chemicals Synthesis的研究成果。该工作构建了金属有机框架(PCN-222)与大肠杆菌自组装杂合体。在光能驱动下,基于野生型大肠杆菌构建的杂合体产氢量为纯菌组的2.9倍,基于工程大肠杆菌构建的杂合体赖氨酸产量为纯菌组的4.3倍,实现了光能驱动合成氢气及高价值化学品。作者研究了材料-生物界面的电子转移机制,通过光电化学测试证明杂合体可以高效捕光且将光生电子转移至生物体内,最后阐述了PCN-222-大肠杆菌光驱产化学品的相关机理。这项工作为基于大肠杆菌的半人工光合系统进行光驱动生物合成的研究奠定了重要基础。

文章上线截图
原文链接:https://doi.org/10.1002/advs.202308597
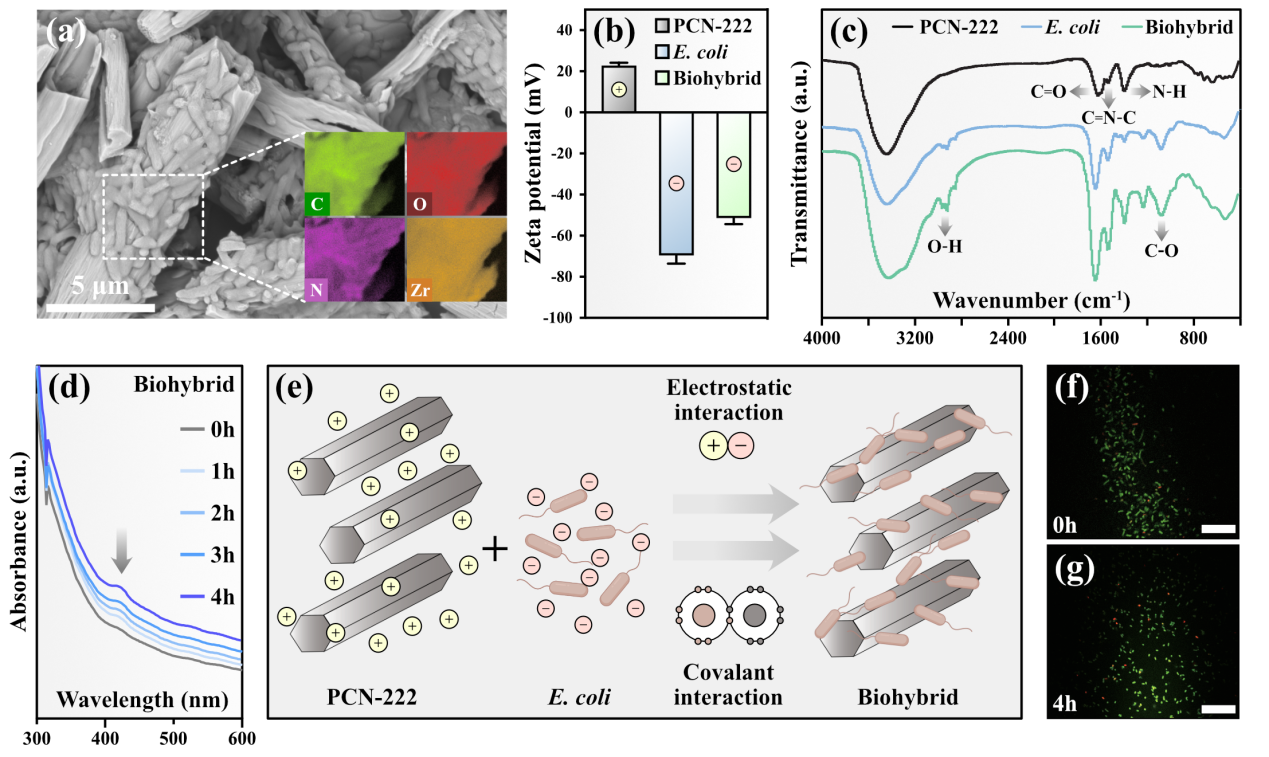
图1. 金属有机框架PCN-222-大肠杆菌杂合体的各项表征
近年来基于锆氧簇构建的MOF材料被广泛应用于光催化研究领域。由于含有卟啉或金属卟啉的MOF材料具有较高的光捕获效率和催化活性,作者首先合成了带正电的锆基卟啉金属有机框架PCN-222并对其物理结构进行了相关表征测试。通过对杂合体的表面形貌进行电镜观察,通过表面电位分析、红外光谱测试,吸收光谱测试,发现通过静电吸附作用及共价作用成功构建了PCN-222与带负电的大肠杆菌杂合体。
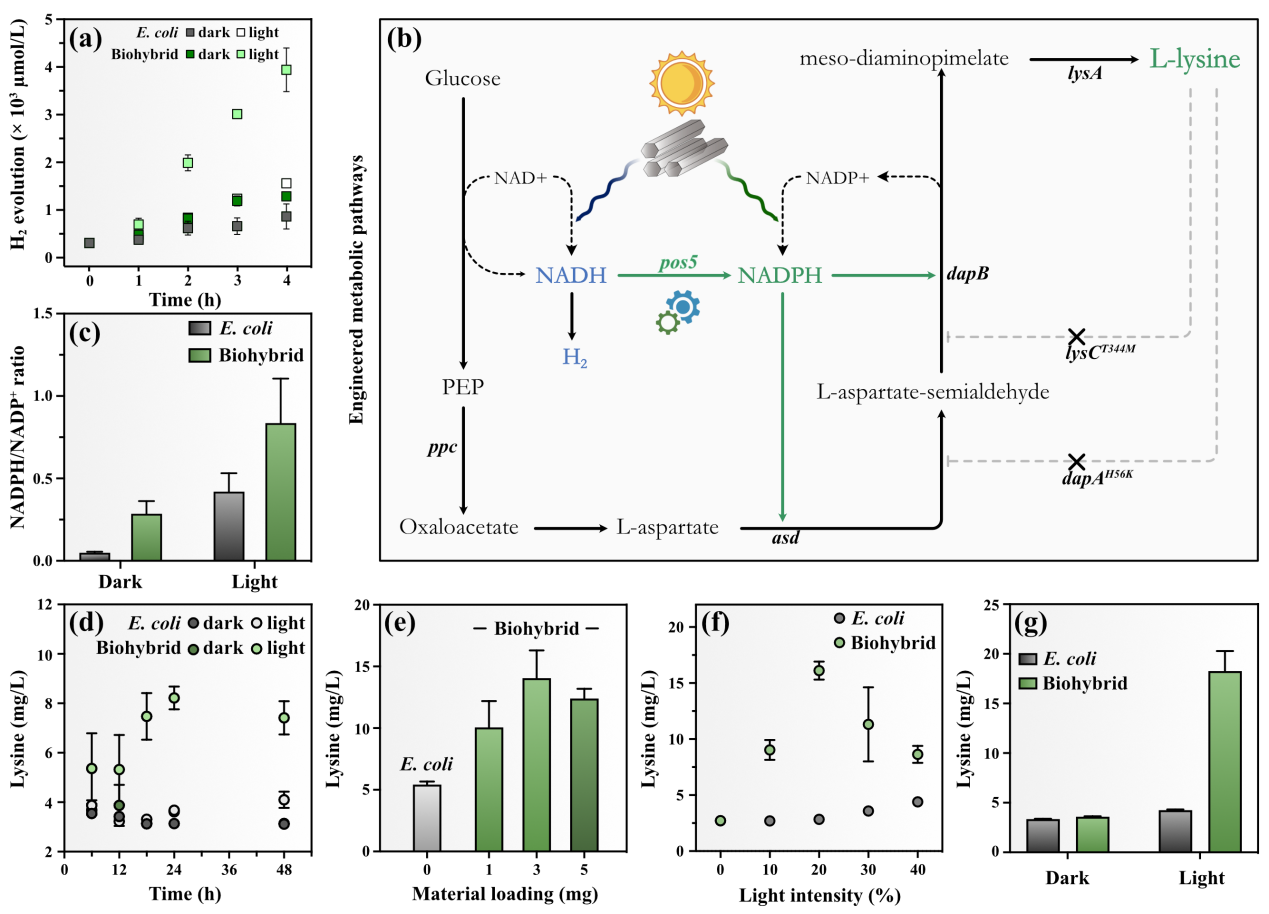
图2. 金属有机框架PCN-222-大肠杆菌杂合体光驱产氢及合成高价值化学品
为了验证PCN-222可以作为大肠杆菌的电子供体,作者首先利用具备产氢能力的野生型大肠杆菌MG 1655与PCN-222结合构建杂合体。该体系实现了在光照下高效产氢,验证了可见光照射下PCN-222对大肠杆菌胞内能量供应有较好的促进作用。随后通过基因工程改造,在大肠杆菌中过表达了赖氨酸合成途径,研究杂合体在黑暗及光照下的赖氨酸合成性能,并分别通过时间梯度、材料与大肠杆菌杂合的时间点、材料的浓度、光照强度四个维度对PCN-222-大肠杆菌杂合体系光驱产赖氨酸性能进行了优化。
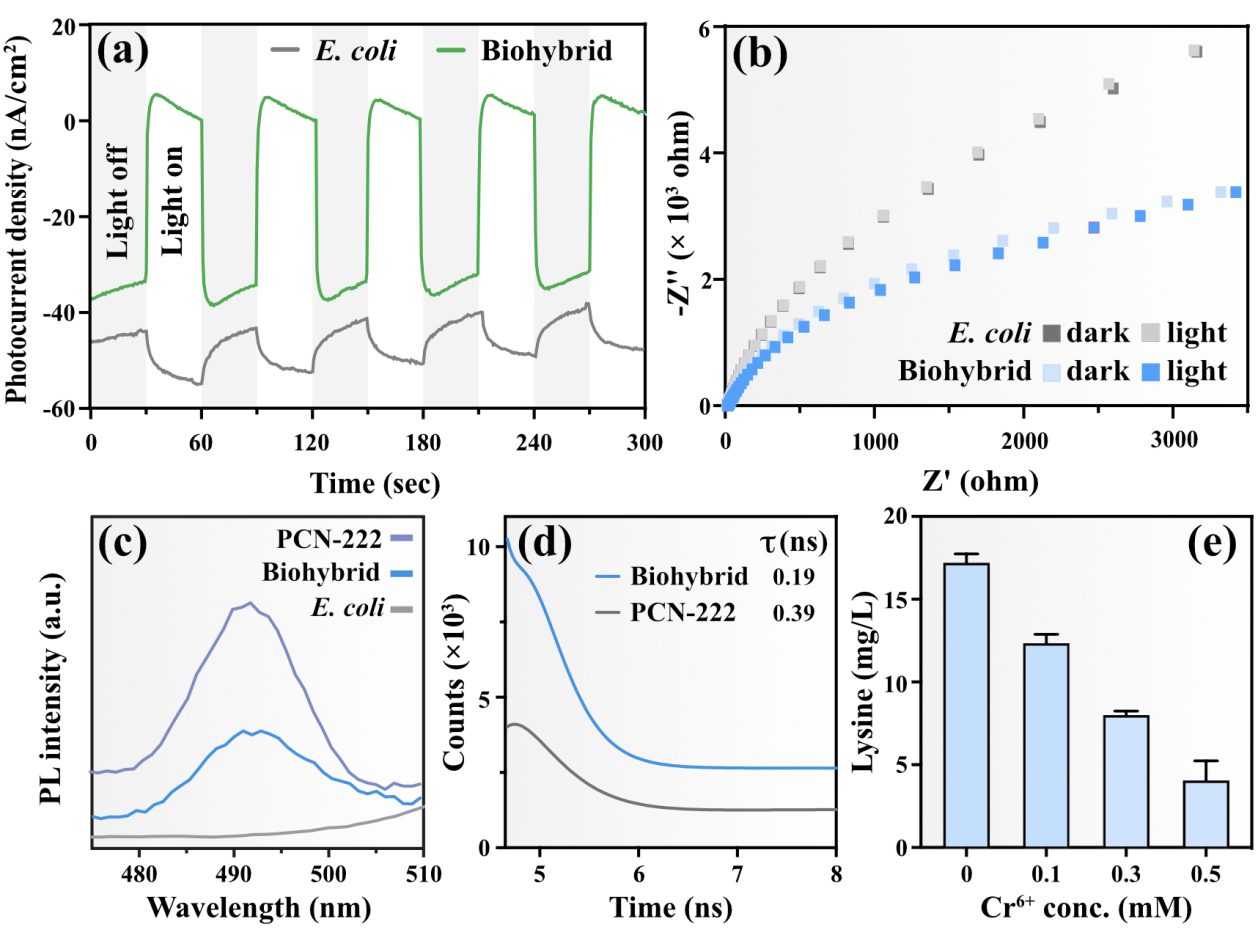
图3. 材料-微生物界面电子转移相关机制
在明确了光驱动赖氨酸生产的最佳条件后,作者重点阐明了该杂合体中的材料-微生物界面的电子转移机制。通过对纯菌和杂合体的光电化学特性进行测试发现,杂合体具有高效捕光且将电子转移至生物体内的能力。为了进一步证实PCN-222能有效地将捕获的光能转移到大肠杆菌中,作者采用光致发光光谱技术(PL)研究了材料-微生物界面上的电子转移。在大肠杆菌细胞内未检测到明显的荧光信号,而杂合体的PL强度明显低于PCN-222。这一结果表明,在杂合体中PCN-222作为电子供体,而大肠杆菌作为电子受体,有效地降低了PCN-222的电子-空穴重组率。随后利用时间分辨光致发光光谱(TRPL)动态地揭示了光反应过程中的界面电子转移。发现杂合体荧光寿命较PCN-222有所缩短,表明PCN-222产生的光生电子可以快速转移至大肠杆菌,与PL的测试结果一致。
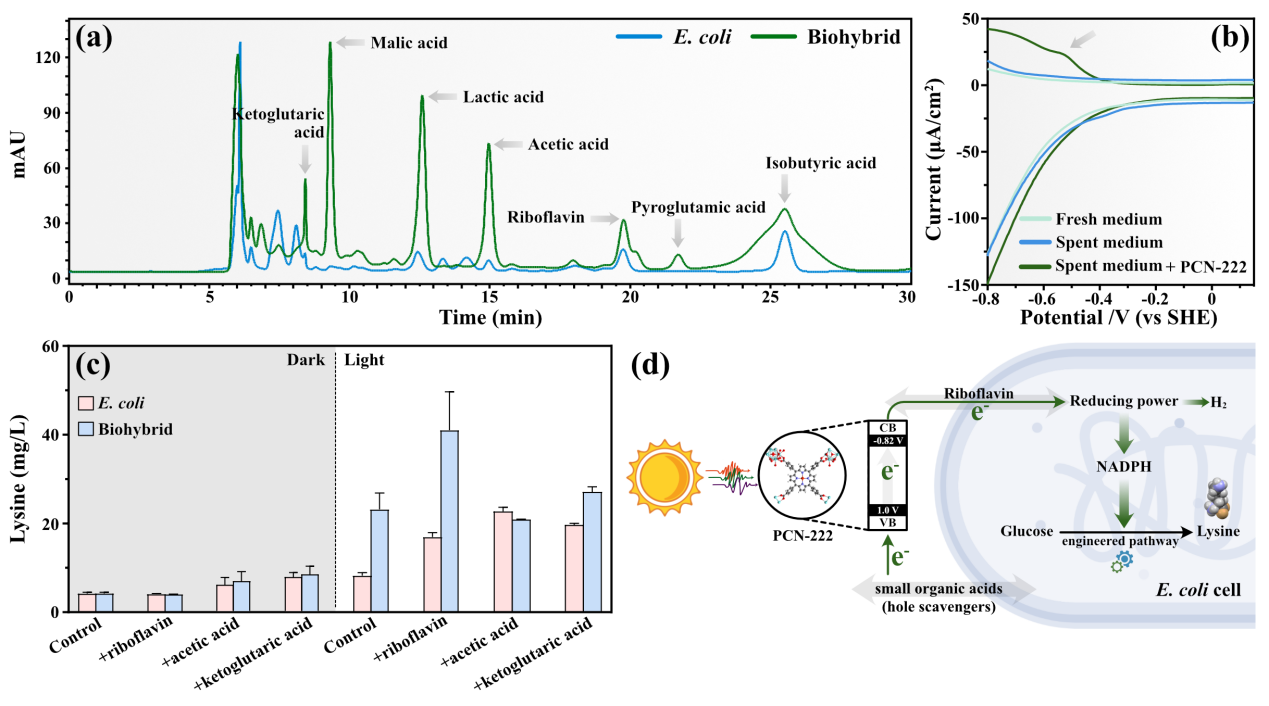
图4. 杂合体光驱动合成氢气及高价值化学品的相关机制
据报道,大肠杆菌分泌的内源性氧化还原物质可以作为电子转移的介质,从而增强了界面电子传输速率。因此,本文推断氧化还原介质可能有助于细菌进行光电子跨膜传递。对反应后杂合体的上清液进行高效液相色谱(HPLC)及差分脉冲伏安法(DPV)分析发现,电子可以通过小分子有机酸及核黄素等氧化还原物质传递至胞内。结合PCN-222在生物产氢中的作用及杂合体界面电子传递的研究结果,本文提出了PCN-222-大肠杆菌杂合体光驱产氢及高价值化学品的机理机制,如图4-d所示。由于静电相互作用,表面带正电的PCN-222与带负电的大肠杆菌自组装成半人工光合系统。在适度的可见光照射下具有优异捕光性能的PCN-222会产生大量的光生电子,通过氧化还原介质传输到大肠杆菌体内。在电子转移方面,PCN-222产生的光生电子可以刺激内源性核黄素的分泌,帮助电子进行跨膜传递。同时,部分小分子有机酸可以作为PCN-222的空穴清除剂,促进电子迁移。因此,在光照下大肠杆菌获得的这些光生电子提高了胞内的还原力水平,导致过量的还原力转化为氢气并促进赖氨酸合成,从而实现了高效光驱动合成氢气及赖氨酸。
该研究得到了科技部合成生物学重点研发计划、国家自然科学基金、广东省重点领域研发专项和深圳合成生物学创新研究院的经费支持。
PI与课题组简介:
王博,副研究员,博士生导师,国家重点研发计划青年首席科学家,中国科学院青年创新促进会成员。团队研究领域为材料合成生物学,实验室主要方向:设计和构建半导体材料与微生物细胞工厂的人工杂合体系,实现光能驱动目标化学品合成,并解析材料-细胞界面电子传递机制和细胞内能量转化机理。近年来以第一作者和通讯作者(含共同)在Advanced Science, Angewandte, Advanced Energy Materials, Energy & Environmental Science, Nano Energy等发表文章20篇。长期招收相关方向的博士后和联合培养的博士生,欢迎联系:bo.wang@siat.ac.cn。