
2023年9月4日晚,中国科学院深圳先进技术研究院合成生物学研究所甘海云课题组在Nature Genetics发表了题为“亲代组蛋白的对称遗传保护小鼠胚胎干细胞分化中的命运”(Symmetric inheritance of parental histones contributes to safeguarding the fate of mouse embryonic stem cells during differentiation)的文章,该研究发现亲代组蛋白对称分配和遗传保证了小鼠胚胎干细胞的分化和早期小鼠胚胎发育。

文章上线截图
文章链接:https://www.nature.com/articles/s41588-023-01477-w
在多细胞生物的发育过程中,基因组通过DNA的半保留复制方式保证了遗传信息被精确地传递到子细胞中。表观遗传则是在基因组信息不变的情况下基因表达的状态发生了可遗传的变化。表观遗传信息决定了不同细胞的命运,是建立和维持细胞类型特异性的基础。对于真核细胞,基因组复制与表观信息的传递紧密相连。
在DNA复制过程中,复制叉前的核小体需要解组装以保证复制体顺利前行。复制叉后两条新合成子链DNA则需要招募新合成组蛋白,并从母链循环回收亲代组蛋白用以重新组装核小体。亲代组蛋白循环和新组蛋白补充的过程被称为DNA复制偶联的核小体组装。
近年来,甘海云研究员与合作者通过开发eSPAN (enrichment and sequencing of protein-associated nascent DNA)技术,发现了DNA复制过程中传递亲代组蛋白的分子伴侣,揭示了亲代组蛋白遗传的分子机制。Mcm2(Mcm2-7解旋酶的一个亚基)通过与Ctf4和Pola1的相互作用将亲代组蛋白传递到复制DNA的滞后链(1)。而Pole3和Pole4(前导链DNA聚合酶的两个亚基)则通过相互作用促进亲代组蛋白传递到前导链(2)。在DNA复制过程中Mcm2-Ctf4-Pola1和Pole3/Pole4保证了亲代组蛋白及其翻译后修饰在姐妹染色单体上的对称分配(图1)。然而,DNA复制中亲代组蛋白如何调控表观信息传递及其生物学意义尚不清楚。
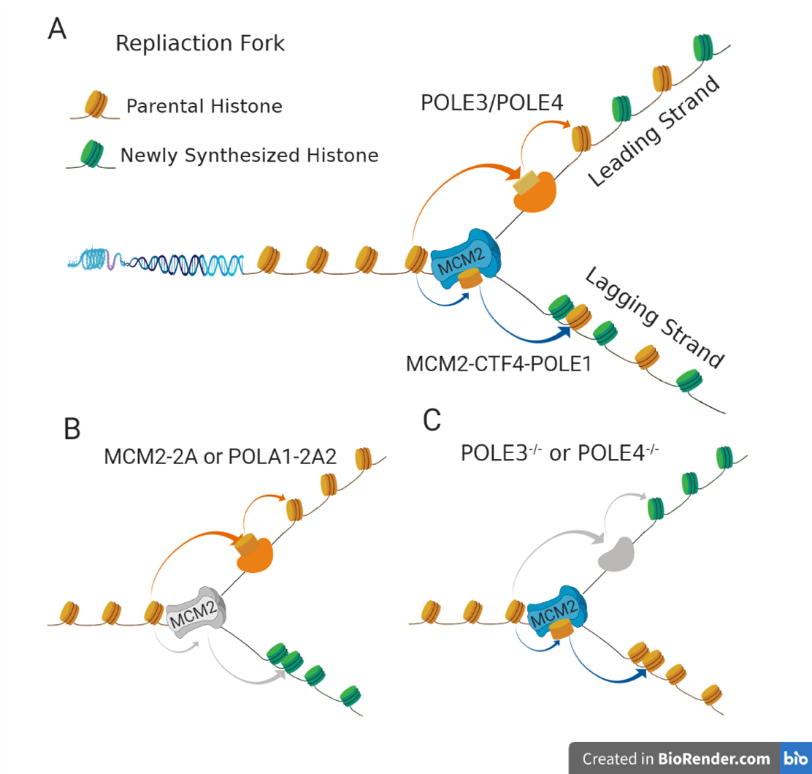
图1 DNA复制耦联的亲代组蛋白表观信息传递
甘海云研究员课题组在前期发现MCM2功能的基础上,通过点突变(Mcm2-2A:Y81A/Y90A)获得缺失MCM2组蛋白结合功能的小鼠胚胎干细胞。研究发现,旧组蛋白(如H3K27me3)分配失衡,组蛋白修饰在全基因组范围的分布出现异常(如H3K27me3, H3K9me3和H3K4me3)(图2),胚胎干细胞向神经细胞分化潜能降低。进一步通过构建Mcm2-2A小鼠发现,纯合子小鼠早期胚胎发育缺陷,胚胎致死。亲代组蛋白对称分配和遗传对胚胎干细胞分化和早期小鼠胚胎发育具有保护作用。
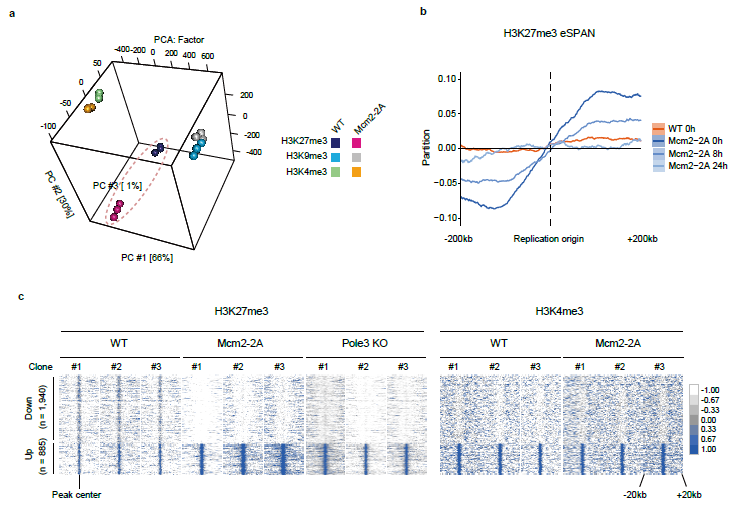
图2 MCM2-2A突变改变胚胎干细胞H3K27me3组蛋白修饰景观
亲代组蛋白携带的修饰蕴含了大量的表观遗传信息(比如与细胞分化和个体发育密切相关的H3K27me3, H3K9me3和H3K4me3)。DNA复制偶联的核小体组装过程中,新生成的染色质包含大约等量的亲代组蛋白和新组蛋白,子细胞中被稀释了一半的组蛋白修饰通过重建恢复到原有水平,比如H3K27me3通过“读-写”机制实现重建。不同组蛋白修饰重建的速度不同,H3K4me3可实现快速重建,而H3K27me3和H3K9me3重建较慢,在一个细胞周期内无法完全恢复。在DNA复制过程中,亲代组蛋白分配失衡可能会导致不同子细胞中遗传了不同的组蛋白修饰分布景观,及其可能导致的转录水平改变。通过单细胞H3K27me3 CUT&Tag,单细胞RNA-seq和LARRY-Barcode谱系追踪技术发现,在向神经细胞分化的体系中Mcm2-2A胚胎干细胞具有向三胚层均分化的趋势。分析发现,H3K27me3分布的异质性增加,转录组异质性也增加(图3),与发育相关基因的转录水平与该基因位点的H3K27me3反向相关。亲代组蛋白分配失衡提高了子细胞群体的基因表达和表观状态异质性,影响了子细胞的命运决定。
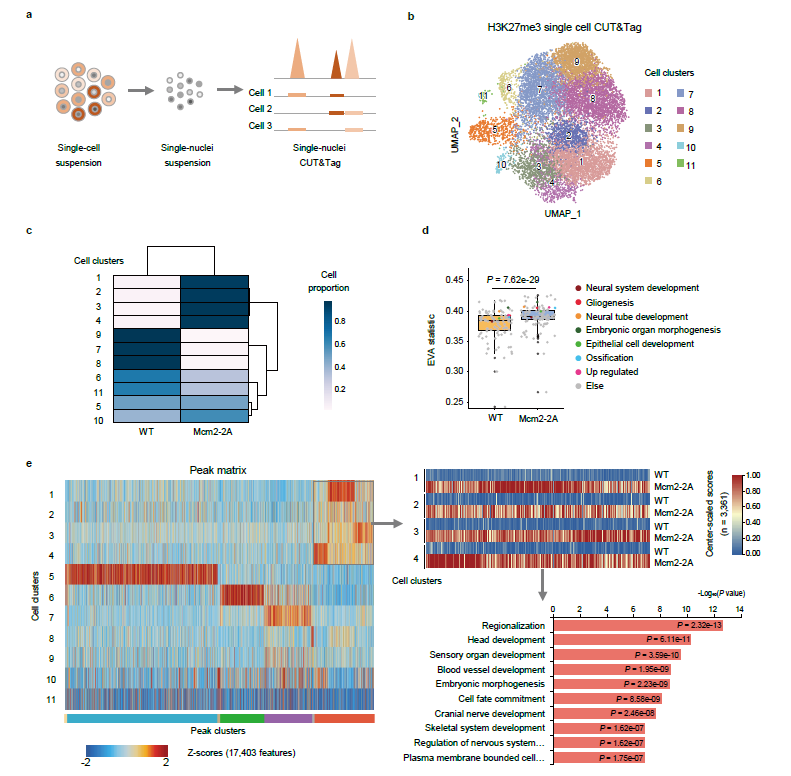
图3 Mcm2-2A突变提高细胞群体中H3K27me3组蛋白修饰景观的异质性
在小鼠胚胎干细胞bivalent基因的启动子位点,组蛋白变体H3.3参与建立正确的H3K27me3分布模式。通过eSPAN发现在Mcm2-2A胚胎干细胞中H3.3表现出滞后链偏好。同时,H3K27me3分布的变化随着H3.3的改变而改变。亲代组蛋白分配失衡,不仅改变了缓慢重建组蛋白修饰的分布,也改变了组蛋白变体的定位,进而在全基因组范围影响组蛋白及其修饰的景观,从而改变了细胞的命运。
该研究结果揭示亲代组蛋白遗传保证了组蛋白修饰景观的遗传,有助于胚胎干细胞分化和小鼠早期胚胎发育。该发现对于理解表观遗传信息在细胞分裂过程中在子代细胞中的分配和继承性具有重要科学意义和潜在贡献。
中国科学院深圳先进技术研究院合成生物学研究所、深圳合成生物学创新研究院甘海云研究员为论文的唯一通讯作者。助理研究员文青、周嘉琦、田聪聪、博士生李欣然、西北农林科技大学客座硕士生宋贵兵为论文的共同第一作者。中国科学院深圳先进技术研究院医药所能量代谢与生殖研究中心雷晓华副研究员及其课题组博士生马驰原、博士后李秦在本研究的小鼠胚胎实验中给予了大力支持和提出了宝贵意见。
该工作获得了国家合成生物学重点研发计划,国家自然科学基金重大项目,中国科学院战略性先导科技专项,国家自然科学基金面上项目、青年项目、广东省自然科学杰出青年基金及深圳合成生物学创新研究院等项目的支持。
专家点评
Pablo Navarro(巴黎西岱大学)
Pablo教授发表评论称:过去几十年的研究在DNA复制过程中染色质状态维持相关的分子机制方面取得了特别丰硕的成果,但仍旧有一个主要问题尚未解决:DNA复制过程中组蛋白修饰的遗传在多大程度上调控细胞的身份?甘海云研究组的这项研究清楚地表明,组蛋白修饰的表观遗传参与了子代细胞身份的正确建立,这表明表观遗传调控不仅仅是稳定已建立的细胞状态。相反,它有力地促进了发育所需的动态变化。
张志国(哥伦比亚大学)
表观遗传信息的正确传递是维持细胞类型和特征的基础。组蛋白表观信息的传递依赖于DNA复制耦联的核小体组装。2018年,我们团队甘海云博士以第一作者或共同第一作者首次报道了Pole3/Pole4和Mcm2-Ctf4-Polα通路分别将携带表观遗传信息的亲代组蛋白传递到前导链和后随链(Yu et al., 2018, Science; Gan et al., 2018, Molecular Cell),实现了表观遗传信息在DNA复制链上的的均等分配。以此研究为基础,中国科学院深圳先进研究院甘海云团队进一步分析了亲本组蛋白对称分布的生物学意义。近日,该团队在Nature Genetics报道了在DNA复制过程中亲代组蛋白翻译后修饰在DNA复制链上的对称遗传对于干细胞体外分化和小鼠个体发育至关重要。该项研究使用致使亲代组蛋白不对称传递的Mcm2-2A突变的小鼠胚胎干细胞和小鼠作为研究模型,得出以下结论:在DNA复制过程中组蛋白翻译后修饰的不对称传递会导致干细胞体外分化和小鼠个体发育的缺陷;抑制性组蛋白修饰H3K27me3产生表观基因组噪声和异质性,进而导致转录组的异质性增加;组蛋白H3.3的定位发生改变;表观基因组的不稳定引起发育相关基因表达异常,最终导致胚胎分化发育的异常。该研究在哺乳动物中首次证明在DNA复制过程中组蛋白翻译后修饰的在DNA链上的对称传递是分化发育的基本特征之一。
李国红(武汉大学生命科学学院/中国科学院生物物理研究所)
在细胞周期的S期,随着整个基因组的复制,染色质状态发生剧烈的变化。亲本核小体需要在复制叉之前被打开或破坏,并立即在新生 DNA 上重新组装。大部分的H3.1-H4四聚体并不会被拆散,新合成的组蛋白也主要以四聚体形式装配到染色质上(3)。抑制性染色质区域的亲本组蛋白主要以精准的原位回收的方式继承,而活跃染色质区域的亲本核小体则是以一种分散的重定位方式进行继承(4)。复制偶联的核小体或染色质组装是将表观遗传信息从亲本传递到子代细胞的第一步。近年来,哥伦比亚大学张志国团队和哥本哈根大学Anja Groth团队的几项重要工作,系统说明了Polε(5, 6)和Mcm2-Ctf4-Polα轴(7, 8)被报道分别负责将带有表观遗传修饰的亲本组蛋白转移到先导链和后随链。然而,前期研究主要围绕分子机制展开,而维持亲本组蛋白在复制叉后两条子链上的均等分配,在分化发育过程中的具体生物学意义仍不明确。
针对这一问题,中国科学院深圳先进研究院甘海云团队,近日在Nature Genetics报道了亲本组蛋白的均等继承与分配,对小鼠胚胎干细胞维持细胞命运的稳定以及正常的神经分化发育至关重要。他们将导致复制叉处不均等分配的点突变Mcm2-2A引入细胞内,通过CUT&Tag他们发现这一突变引起了广泛的表观遗传景观的紊乱,其中最显著的是组蛋白H3K27me3的染色质占位改变。通过进一步分析他们发现,改变的H3K27me3占位主要发生在神经发育相关基因区域。进一步,他们发现在诱导Mcm2-2A突变小鼠胚胎干细胞向神经前体干细胞(NPC)分化时,许多细胞不能完成分化。于此一致的是,在他们构建的Mcm2-2A突变小鼠模型中,纯合突变细胞不能正常发育。随后他们利用LARRY技术给小鼠胚胎干细胞加上DNA标签,结合单细胞CUT& Tag,单细胞RNA-seq等技术系统证明了由小鼠胚胎干细胞中Mcm2-2A突变所导致了子链上H3K27me3的不均等分配在NPC分化过程中,引起了细胞群体中H3K27me3分布的异质性增加,进而导致转录组的异质性增加。所以小鼠胚胎中部分细胞的发育相关基因不能被正常激活,最终导致分化发育的异常。此外,他们还揭示了组蛋白变体H3.3在此过程中对于H3K27me3潜在的调控作用。实验设计非常巧妙,研究思路非常清晰。
值得一提的是,这项研究中甘海云团队通过H3K27me3 eSPAN,他们发现在复制叉处不均等分配后,两条子链上的H3K27me3在随后的恢复过程也会出现差异,进而产生了两个染色质状态不同的子代细胞。我们课题组近期报道H1介导的染色质压缩调控H3K27me3在复制后的动态恢复(9)。如果将H1介导的染色质压缩破坏, H3K27me3恢复会受损,从而导致小鼠胚胎干细胞命运维持异常。我们的这一发现与甘海云团队的结果相互印证,说明了DNA复制过程中亲本H3K27me3的均等分配和回收,同时通过正反馈机制和核小体-核小体配对原则,使得子代细胞新生成染色质上的H3K27me3快速重建和恢复到亲本的水平,从而维持细胞命运与身份,在个体发育和细胞分化中发挥重要作用。并由此引申出许多重要的科学问题,亲代细胞中不同的染色质结构是如何继承到子代细胞中的?破坏亲本组蛋白的均等分配是否会导致子代细胞染色质高级结构改变?是否影响子代细胞中启动子-增强子等重要功能元件的相互作用?
综上所述,甘海云团队的这项工作实验设计巧妙,利用多种模型在细胞水平和小鼠个体上证明了携带大量表观遗传信息的亲本组蛋白在DNA复制过程中均等分配到两个子代细胞新生成染色质中的重要性。在此,再次祝贺甘海云团队在染色质复制机制研究方向上取得又一重要进展,期待他们团队在后续研究中取得更多的突破。
参考文献
1. Gan, H. et al. The Mcm2-Ctf4-Polalpha Axis Facilitates Parental Histone H3-H4 Transfer to Lagging Strands. Mol Cell 72, 140-151 e3 (2018).
2. Yu, C. et al. A mechanism for preventing asymmetric histone segregation onto replicating DNA strands. Science 361, 1386-1389 (2018).
3. M. Xu et al., Partitioning of histone H3-H4 tetramers during DNA replication-dependent chromatin assembly. Science 328, 94-98 (2010).
4. T. M. Escobar et al., Active and Repressed Chromatin Domains Exhibit Distinct Nucleosome Segregation during DNA Replication. Cell 179, 953-963.e911 (2019).
5. C. Yu et al., A mechanism for preventing asymmetric histone segregation onto replicating DNA strands. Science 361, 1386-1389 (2018).
6. Z. Li et al., DNA polymerase alpha interacts with H3-H4 and facilitates the transfer of parental histones to lagging strands. Sci Adv 6, eabb5820 (2020).
7. N. Petryk et al., MCM2 promotes symmetric inheritance of modified histones during DNA replication. Science 361, 1389-1392 (2018).
8. H. Gan et al., The Mcm2-Ctf4-Polα Axis Facilitates Parental Histone H3-H4 Transfer to Lagging Strands. Mol Cell 72, 140-151.e143 (2018).
9. C. Liu et al., Histone H1 facilitates restoration of H3K27me3 during DNA replication by chromatin compaction. Nat Commun 14, 4081 (2023).
PI与课题组简介:
甘海云博士,中科院深圳先进技术研究院合成生物学研究所研究员,博士生导师。近五年来研究成果发表在Science、Nature Medicine、Nature Genetics、Molecular Cell、Nature Communications、Genes & Development、PNAS、eLife、The EMBO Journal、Nucleic Acids Research等知名期刊,累计引用超过3000次。
课题组主要研究方向为利用系统生物学、合成生物学以“干湿”实验结合的模式研究表观基因组信息的传递机制以及其在肿瘤发生和耐药性产生、全能性细胞(2C)、细胞衰老、染色体外DNA(ecDNA)、合成表观重构、DNA复制起始分子复合物、人工细胞等的表观遗传调控机制。
课题组现招聘有表观基因组学、合成生物学、生物信息学学、肿瘤生物学、细胞生物学、等任一相关研究背景博士后1-2名,研究助理2-3名,欢迎志同道合的朋友投送简历至hy.gan@siat.ac.cn,简历及邮件标题注明“应聘岗位-学校名称-专业-姓名”。