
8月19日,中国科学院深圳先进技术研究院合成生物学研究所合成微生物组中心马迎飞团队以非模式沙门菌噬菌体selz为研究对象,通过CRISPR-Cas9构建并筛选到具有高效穿越哺乳动物上皮细胞的工程噬菌体selzHA-TAT,可用于胞内感染细菌的清除,为临床胞内细菌感染治疗提供新型治疗方案,相关研究成果以“Engineered phage with cell-penetrating peptides for intracellular bacterial infections”为题发表于国际学术期刊mSystems。
中国科学院深圳先进技术研究院客座博士研究生赵敏为文章的第一作者,中国科学院深圳先进技术研究院研究员马迎飞和助理研究员谭新与重庆医科大学余加林教授为共同通讯作者。

文章上线截图
文章链接: https://doi.org/10.1128/msystems.00646-23
鼠伤寒沙门氏菌在感染过程中可进入宿主细胞内繁殖,造成感染迁延难愈。由于传统抗生素难以有效进入细胞,达到有效杀菌浓度;同时,随着耐药细菌全球流行,临床上迫切需要一种新的方法来治疗由耐药菌引起的细胞内感染。噬菌体作为细菌天敌,可用于治疗耐药菌感染,然而其进入细胞的能力有限,极大地限制了其在治疗胞内菌感染中的应用。近年来随着合成生物学的发展,利用基因编辑技术构建穿膜肽(Cell-penetrating peptide,CPP)展示工程噬菌体以杀灭胞内菌成为可能。目前,关于噬菌体展示技术主要在大肠杆菌相关模式噬菌体开展。但自然界中噬菌体多样性极高,研究人员对可修饰的结构蛋白了解甚少及众多未知功能基因等极大的限制了非模式噬菌体合成生物学改造的开展。
基于以上背景,团队通过生物信息学方法初步筛选到一株具有噬菌体展示潜力的非模式沙门噬菌体selz,并通过Western-Blot及电镜拍摄进一步验证了该噬菌体的GP94结果蛋白可用于短肽展示(图1)。通过CRISPR-Cas9技术进行基因编辑,获得了7种不同穿膜肽展示的工程噬菌体,由于穿膜肽携带噬菌体进入细胞受多种因素影响包括噬菌体大小、穿膜肽浓度、细胞类型等等。团队进一步通过双层平板测噬菌体滴度实验及激光共聚焦实验在不同细胞类型上进行穿膜肽修饰工程噬菌体的穿膜功能筛选,成功筛选到一株可高效进入上皮细胞的工程噬箘体selzHA-TAT(图2),进一步通过体外细胞实验验证了该噬菌体可以用于治疗胞内沙门氏菌感染,为穿膜肽展示工程噬菌体用于胞内菌防治工作提出了治疗新思路。
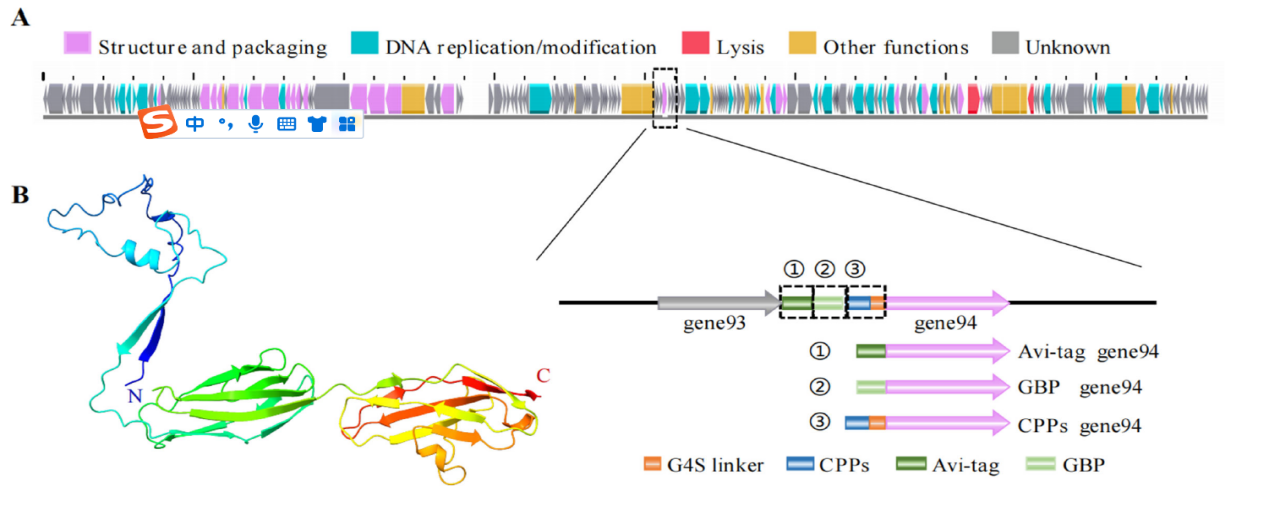
图1 Selz噬菌体展示短肽标签的验证。

图2 工程穿膜噬菌体在上皮细胞的穿膜效果。
该研究得到了科技部重点研发计划、中科院先导B、中科院定量工程生物学重点实验室及深圳合成生物学创新研究院的资助。