
7月31日,中国科学院深圳先进技术研究院、香港大学与贝湾生物科技有限公司合作,在国际学术期刊Cell Host & Microbe (IF=30.3) 发表了题为“Rational design of booster vaccine strain against COVID-19 based on antigenic distance”的研究论文。该研究提出了疫苗动态更新的定量生物学策略,发现接种两针基于始祖毒株的疫苗之后,接种基于非典病毒的疫苗可以提供更为长效广谱的保护,并提出“抗原场(Antigenic Field)”理论以更好地理解和定量人体免疫系统与外来抗原之间的相互作用(免疫反应)。

文章上线截图
文章链接:https://doi.org/10.1016/j.chom.2023.07.004
近年来,随着对病毒研究进展的迫切需求,人们对病毒基因功能和结构的认识不断深入,优化设计和与病毒“竞赛”研究方向备受关注。传统的与病毒竞赛是通过跟随策略:世界卫生组织(WHO)定期与各个合作中心和实验室的专家进行磋商,分析全球流感病毒数据,为下一个流感季节开发疫苗提供推荐疫苗组分。
这种跟随式的开发策略应用在COVID-19上可能会慢“毒”一拍:以贝塔毒株(Beta, B.1.351)为例,该毒株于2020年12月在社会面大量传播,2021年1月针对贝塔毒株的疫苗开始临床试验,但在2021年7月2a期临床试验期中分析出炉,传播的主要毒株已变为德尔塔(Delta,B.1.617.2/AY.1)。是否可以开发新策略能够跑赢新冠突变毒株,使对抗病毒免疫策略能够动态更新呢?
在该工作中,研究团队通过定量建模和理性设计开发了一种可用于疫苗动态更新研究的新型策略,将定量建模应用在新冠病毒逃逸分析中,提出“抗原场”理论,为病毒疫苗开发等提供重要思路。
研究者首先根据已有的中和数据和测序数据进定量建模,构建了“抗原距离”模型用来衡量不同突变株之间的免疫逃逸。针对不同毒株的抗原,人体会产生不同的血清;反之,人体在中和不同毒株时,其中和能力也有不同。通过不同血清和不同的毒株的交叉中和,可以最终测定处不同的毒株之间的抗原距离,并通过数据降维绘制抗原地图(图1)。
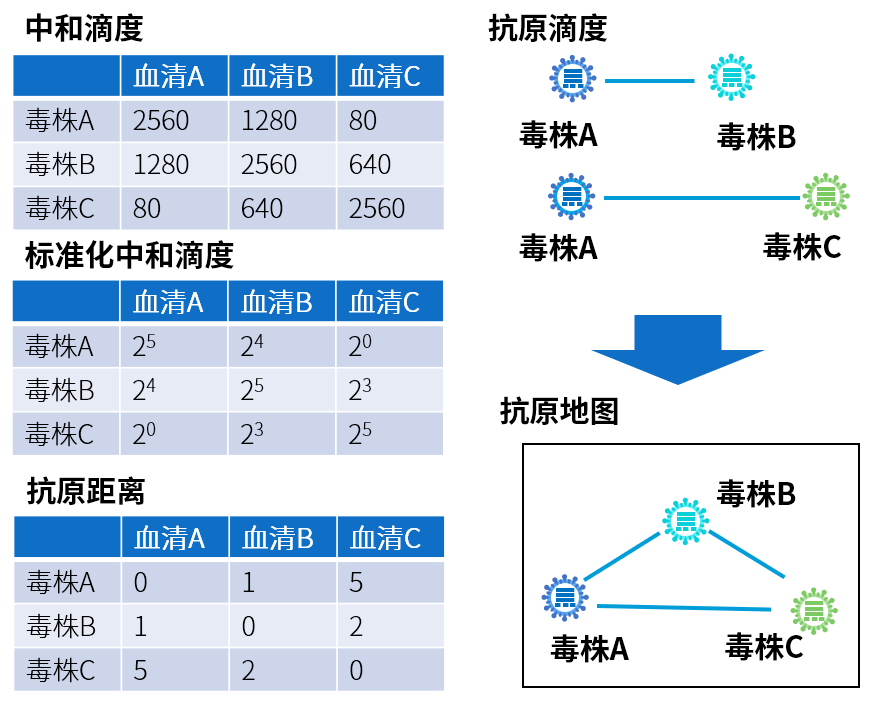
图1 抗原距离与抗原地图的绘制。
通过这一工具,研究者绘制了新冠的抗原地图,并预测了采用不同毒株的作为免疫加强针的保护范围,包括了新冠始祖毒株(Ancestral SARS-CoV-2)、新冠德尔塔毒株(SARS-CoV-2 Delta,B.1.617.2/AY.1)、新冠奥密克戎毒株(SARS-CoV-2 Omicron,B.1.1.529/BA.1)、非典冠状病毒(SARS-CoV-1)和中东呼吸综合征冠状病毒(MERS-CoV)在内的候选毒株。模型结果显示,非典冠状病毒(SARS-CoV-1)作为疫苗株有望提供更广的保护力范围。而德尔塔毒株(SARS-CoV-2 Delta,B.1.617.2/AY.1)作为疫苗株虽然不及非典冠状病毒(SARS-CoV-1)的效果,但仍优于新冠奥密克戎毒株(SARS-CoV-2 Omicron,B.1.1.529/BA.1)。
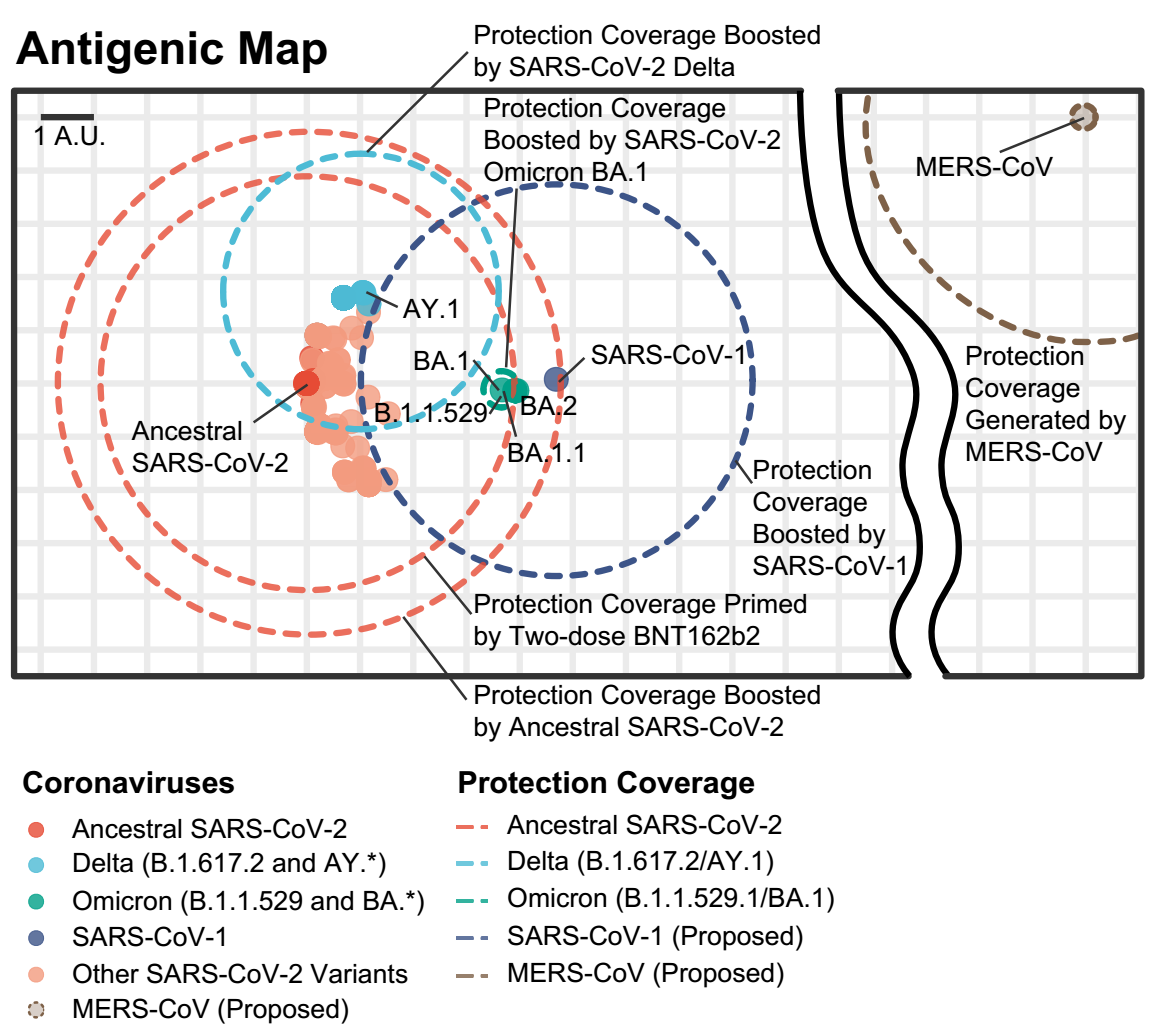
图2 新冠的抗原地图和不同疫苗株的保护力范围
研究者首先通过人类的血清样本进行验证。一共招募了6组不同的志愿者进行比较,包括:(1)接种了两剂mRNA疫苗的志愿者;(2)只感染过新冠始祖毒株的志愿者;(3)接种了两剂mRNA疫苗随后突破性感染新冠德尔塔毒株(Delta)的志愿者;(4) 只感染新冠德尔塔毒株(Delta)的志愿者;(5)接种了两剂mRNA疫苗随后突破性感染新冠奥密克戎毒株(Omicron)的志愿者;(6) 只感染新冠奥密克戎毒株(Omicron)的志愿者。其中第(3)组的志愿者的数据报告展现出更广的中和能力,其血清对新冠始祖毒株(Ancestral SARS-CoV-2)、新冠德尔塔毒株(SARS-CoV-2 Delta,B.1.617.2/AY.1)、新冠奥密克戎毒株(SARS-CoV-2 Omicron,B.1.1.529/BA.1)的假病毒中和抗体滴度均表现较好,这初步证明了模型的准确性。
随后,研究者在小鼠模型中进行了进一步验证之前的模型。首先给小鼠接种了两剂mRNA疫苗,随后接种不同毒株作为疫苗株。小鼠的血清学结果显示,非典冠状病毒(SARS-CoV-1)疫苗株在中和抗体水平和特异性抗体水平方面均优于其他候选疫苗。在活病毒挑战试验中,非典冠状病毒(SARS-CoV-1)疫苗株也能提供更好的保护。
从抗原距离到抗原场
在该论文的最后,研究者提出了一个新概念:“抗原场”,以更好地理解和定量人体免疫系统与外来抗原之间的相互作用(免疫反应)。这是一个与“电场”类似的概念,“抗原场”是免疫空间中存在着的基本相互作用。“抗原场”是一个标量场,具有以下特点:
(1)感染或接种某一抗原会产生“抗原场”。这种抗原场在“激发”之后,可以“排斥”后面试图进入该场同一抗原,或与该抗原在抗原距离上较近的抗原,“抗原场”的强度与抗原的免疫原性正相关,这种“排斥”就是免疫保护,后进入的抗原与“激发”抗原的之间的抗原距离越近,则“排斥”的强度越大,即免疫反应越强。
(2)“抗原场”的叠加是非线性的。在前一个抗原“激发”了免疫场之后,后进入的抗原仍可以“激发”新的抗原场。如果前后两个抗原之间抗原距离较近,那么新的抗原被移入一个已存在的“抗原场”需要克服已存在的“抗原场”的“排斥”强度,然后才能产生它自己的“抗原场”;否则只是加强了已存在的“抗原场”。
(3)这实际上可用于解释免疫印记现象。免疫印记(immune imprinting),也称为原始抗原痕迹,这是一种免疫记忆唤醒使免疫反应偏向于先前遇到的抗原的现象,尤其发生在反复暴露于同一或类似抗原时。在开发新冠疫苗加强针时要尽量避免或者客服这种免疫印记。新的抗原接种是否能克服由之前抗原产生的免疫印迹,取决于新旧抗原之间的“抗原距离”。
(4)不同的疫苗接种策略将产生不同的“抗原场”。因此,优化的疫苗接种策略需要确定一系列能够产生具有最大覆盖面和强度的“抗原场”的抗原。“抗原场”的强度也会随着时间而衰减,用“抗原场”的语言可以更全面地描述疫苗有效性、交叉反应性和持续时间。
香港大学医学院生物医学学院黄建东教授、微生物系朱轩助理教授和中国科学院深圳先进技术研究院合成生物学研究所张宝中副研究员为该论文通讯作者。贝湾生物科技有限公司CEO胡叶凡博士、香港大学医学院博士后袁梓泰、深圳先进技术研究院博士后龚华锐、香港大学医学院博士生胡冰杰、硕士生胡景初、博士生林轩圣为论文第一作者。
该研究获得国家重点研发计划及深圳合成生物学创新研究院的支持。
专家点评
童贻刚教授 (北京化工大学生命科学与技术学院院长)
这是令人兴奋的创新工作,作者通过理性推断、计算机模拟预测和实验验证,多维度证明抗原设计在疫苗开发过程中的重要性。大部分人群感染新冠或者接种疫苗后产生的保护性抗体衰减得过快,且新冠病毒变异因为大量的感染基数而出现过快,传统疫苗设计制造更注重剂型选择和佐剂开发,这种疫苗设计思路使得疫苗更新难以应付病毒的变异。黄建东教授、朱轩博士和张宝中博士的工作为疫苗研发开辟了新思路,证明基于“抗原距离”的抗原设计在疫苗开发过程中的重要价值,根据这一策略可以开发出更加广谱、更加长效的疫苗。更有意思的是,他们的结果显示,根据非典病毒设计的加强针可以广谱预防新冠突变株。这一思路不仅可以用于新冠疫苗开发,还有望为其他疫苗如季节性流感疫苗开发提供重要思路。
专家点评
汤雷翰教授 (香港浸会大学教授计算及理论研究所主任)
黄建东教授、朱轩博士和张宝中博士合作的工作展现了交叉学科研究如何推动传统生物医学研究。特别是这篇工作提出的“抗原场”这一全新理论,描绘了给免疫学的物理图像,为定量研究提供了新的思路。
传统上免疫学甚至是生命科学的定量研究较少使用到“场”这一语言,实际上物理上的“场”常常被用来描述物质之间的相互作用,黄建东教授和胡叶凡博士注意到了复杂免疫学过程或者免疫反应实际上描述的就是相互作用,他们将“场”引入到了免疫原性描述之中,提出了“抗原场”这一全新理论。他们通过建模构建描述免疫原性的抗原空间,为开发下一代的新冠疫苗提供了理论上的指导,并在实验中加以验证。这一工作初步显示出了这一理论模型的预言预测的能力。这一理论模型有望进一步推广,用来描述其他免疫互作,这将为我们深入理解复杂免疫过程提供新的工具。