
北京时间4月12日,中国科学院深圳先进技术研究院合成生物学研究所马迎飞课题组与戴磊课题组合作在Cell Host & Microbe发表题为“Large-scale phage cultivation for commensal human gut bacteria”的最新研究成果,该工作首次建立了大规模肠道主要共生细菌噬菌体培养组技术,利用噬菌体培养物解析了肠道细菌和噬菌体长期共存的机制,并展示了这些噬菌体在肠道菌群调控中的应用潜力。
 文章上线截图
文章上线截图
文章链接:https://doi.org/10.1016/j.chom.2023.03.013
研究显示,噬菌体是人体微生态系统中最多样化却仍未被准确识别的成分。这些噬菌体和其宿主细菌之间的相互作用影响着人体健康。利用噬菌体疗法精准靶向调节肠道菌群是当前肠道微生物研究的前沿领域。鉴于噬菌体-细菌之间复杂的关系,解析肠道微生物群落中的噬菌体结构、组成和功能,对于开展针对肠道重要致病菌的噬菌体疗法至关重要。此外,宏基因组研究发现肠道中细菌和噬菌体可以长期稳定共存,它们能够稳定共存的机制是什么?开展以上研究,如何获得肠道细菌的噬菌体培养物是当前人体肠道微生物组研究中亟待解决的问题。
科研团队针对肠道常见共生细菌开发了一系列噬菌体分离培养技术。在测试的源自健康人的411株肠道共生细菌中,成功获得了可以分别侵染其中42种细菌的209株非冗余噬菌体。这些菌包括15种拟杆菌、19种厚壁菌、4种放线菌和4种变形菌。这209个噬菌体,基因组大小在12kb-168kb之间,超过80%的噬菌体属于尚未被描述的分类属,显示了这些噬菌体具有很高的新颖性和多样性。
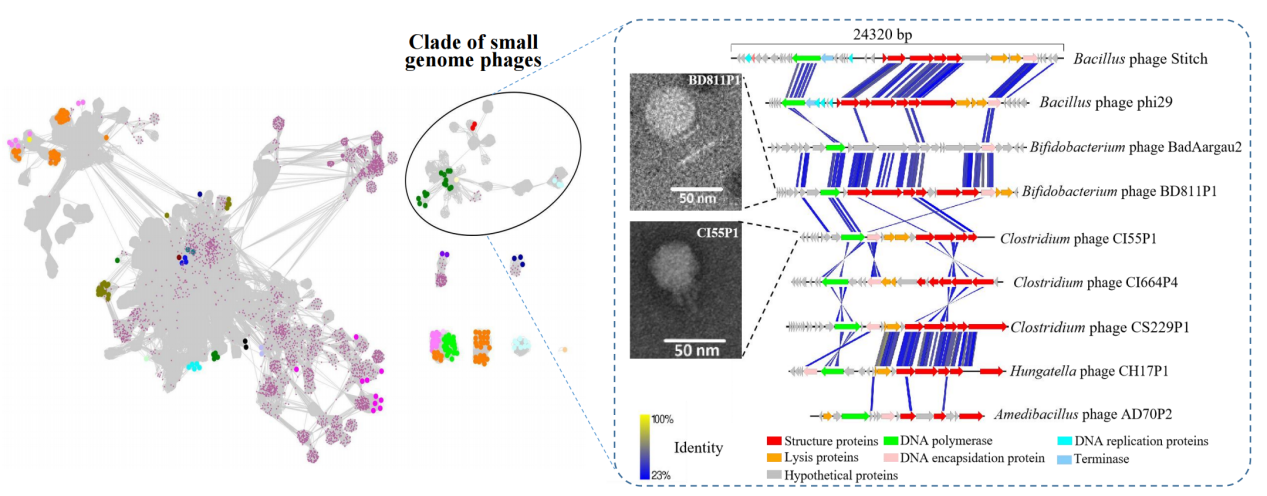
有趣的是,这些可培养的噬菌体中包含一类拥有极小基因组的有尾噬菌体,其基因组大小在10-20 kbp之间,并且分类上形成了一个独立的分支。它们的宿主细菌全部属于革兰氏阳性菌,这其中包括在人体肠道中广泛存在的双歧杆菌和梭菌。根据ICTV对有尾噬菌体分类的标准,所有这些小基因组噬菌体都被归类为Salasmaviridae病毒科,分别属于两个亚科和83个属。电镜照片显示Salasmaviridae噬菌体属于短尾噬菌体(图1),头部直径在30-50nm,基因组具有相似的组织结构,并拥有保守的直系同源蛋白,如DNA 聚合酶等。此外,还发现有2株噬菌体PD491P1和AS73P1所代表的类群比crAss-like噬菌体(crAss-like噬菌体被认为是人体肠道中分布最广泛的噬菌体)在人群中有着更为广泛的分布(图2)。这些噬菌体的宿主细菌都属于拟杆菌目,包括Bacteroides、Alistipes、Odoribacter、Parabacteroide、Prevotella和Barnesiella等人体肠道中主要的拟杆菌成员,但是和其它已经分离的这类细菌的噬菌体显著不同,形成了一个独立的分支,根据ICTV对有尾噬菌体分类的标准,科研团队将这些噬菌体归类为一个新的噬菌体科,暂命名为Paboviridae。
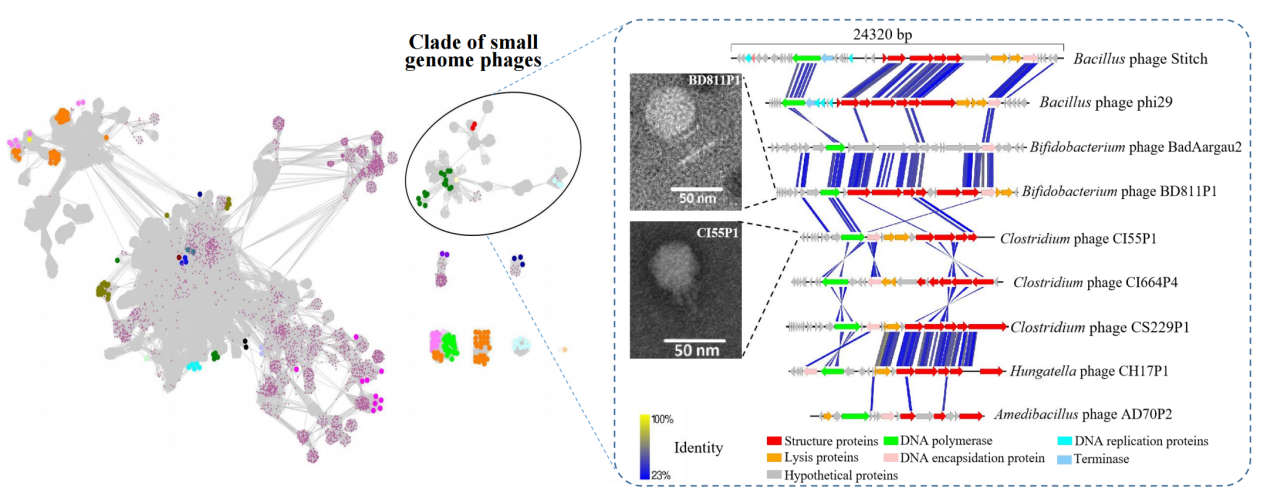 图1:人体肠道中小基因组噬菌体的发现与表征
图1:人体肠道中小基因组噬菌体的发现与表征
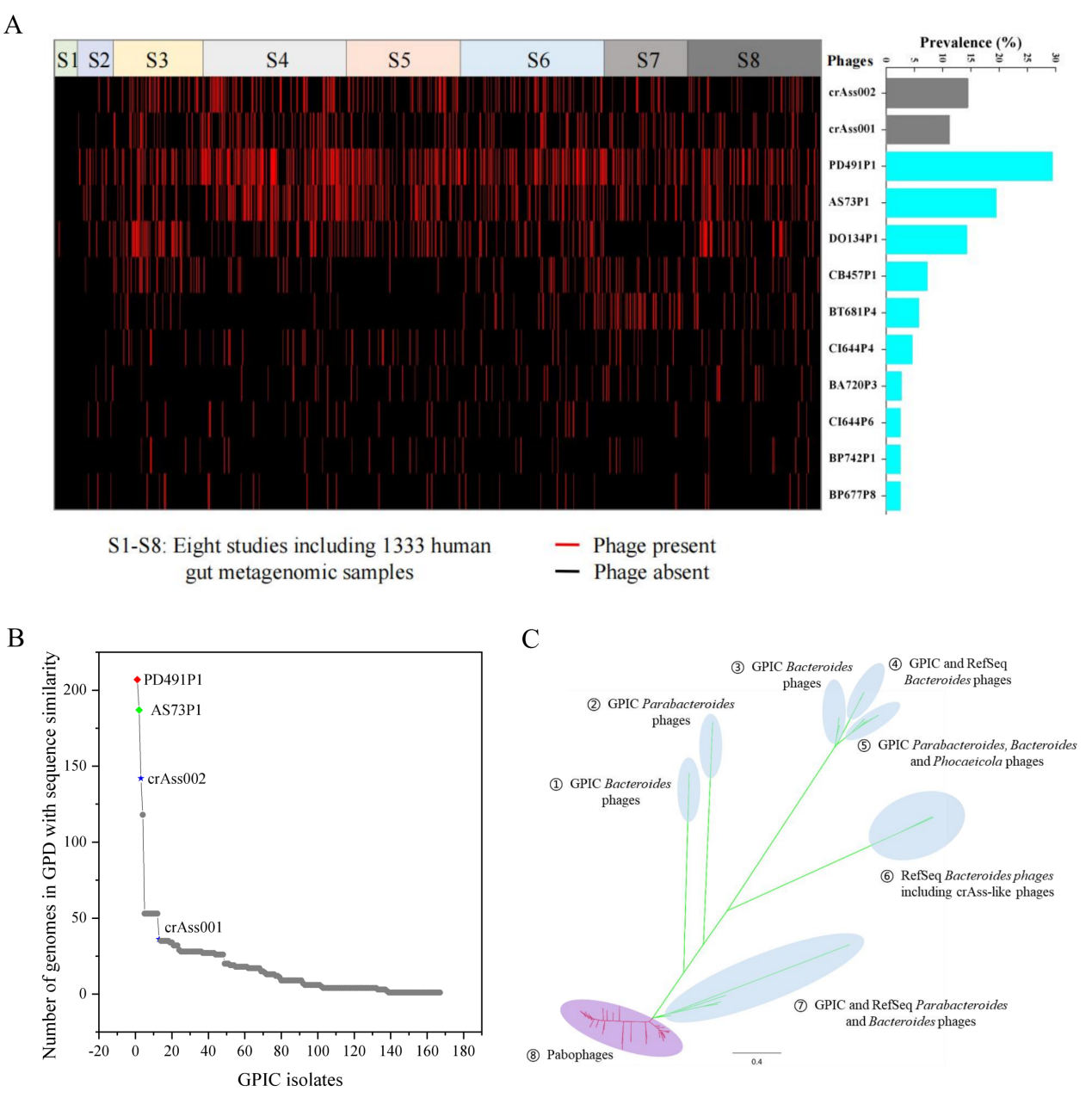 图2:人体肠道高流行率的噬菌体新科 Paboviridae的发现
图2:人体肠道高流行率的噬菌体新科 Paboviridae的发现
之前的生物信息学分析表明,约三分之一的人类肠道噬菌体可能具有广泛的宿主范围。科研团队选取拟杆菌和副拟杆菌的噬菌体测试其宿主谱的范围。在上千次的交叉侵染测试中,均没有观察到噬菌体跨种侵染宿主的现象,表明这些噬菌体具有高度的宿主特异性(图3A)。而且发现这些来自同一个种的细菌在菌株水平也表现出了多样性的噬菌体敏感性,即使这些细菌来自同一个人的粪便样本(图3B),表明肠道细菌在菌株水平存在复杂多样的噬菌体抗性机制。因此,肠道细菌在菌株水平多样性的噬菌体抗性机制是肠道细菌和噬菌体长期稳定共存的重要原因。
最后,为了证明使用GPIC噬菌体调节人类肠道菌群的可行性,团队选择了8种具有不同基因组序列和不同宿主特异性的脆弱拟杆菌噬菌体,组成了具有广宿主范围的噬菌体鸡尾酒。在三位供体粪便样本的肠道菌群体外培养体系中,噬菌体添加24h后,脆弱拟杆菌的丰度均显著降低了,同时伴随着菌群组成的剧烈变化(图3C和3D)。在更长时间的连续培养中,噬菌体鸡尾酒也可以降低脆弱拟杆菌的丰度(图3E和3F),显示出对目标物种的持久敲低作用。
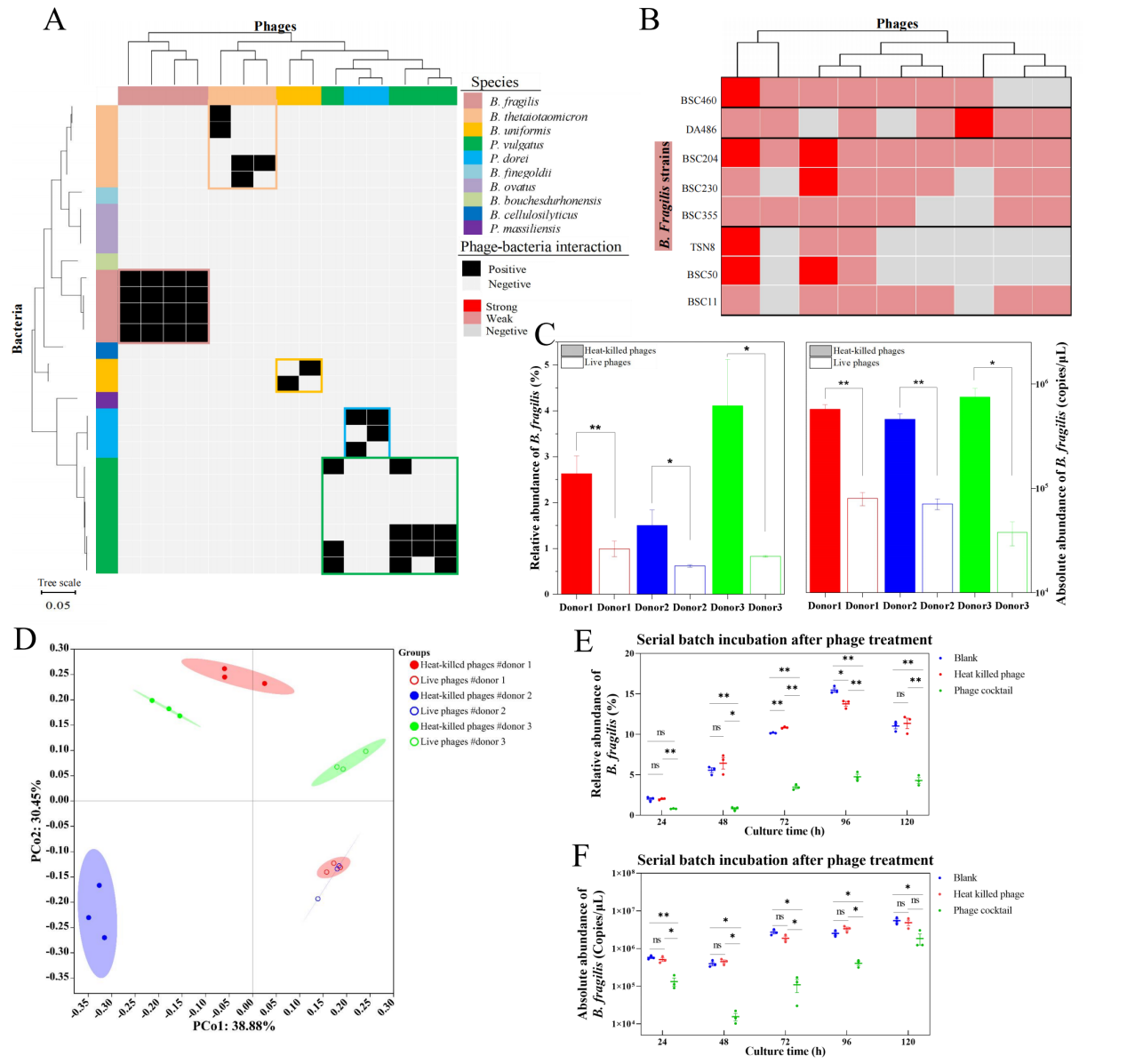 图3:人体肠道噬菌体的宿主特异性与菌群调控作用
图3:人体肠道噬菌体的宿主特异性与菌群调控作用
综上,本研究针对肠道主要共生细菌构建噬菌体资源库,展示了这些噬菌体培养物在肠道菌群调控中的价值。利用这一资源拟开展的肠道噬菌体和细菌的互作研究,有助于深入了解肠道微生物组的多样性、功能和作用,为预防和治疗相关疾病提供新的思路和方法。
中科院深圳先进院马迎飞研究员和戴磊研究员为该论文的共同通讯作者,助理研究员沈俊涛为该论文的第一作者,该研究工作依托深圳合成生物研究重大科技基础设施完成,也得到了清华大学深圳国际研究生院李炳团队和香港大学张彤团队提供的重要帮助。
该工作得到国家重点研发计划(2019YFA0906700),中国科学院先导科技专项(XDB29050501),国家自然科学基金(31971513、32061143023),广东省基础与应用基础研究基金(2020A1515110184)和深圳合成生物学创新研究院等项目的资助。