
NK细胞(天然杀伤细胞,Natural Killer cells)不仅是抗肿瘤的直接效应细胞,而且对于抗肿瘤T细胞应答及基于T细胞的卡控点免疫疗法还发挥重要的辅助作用。但目前NK细胞辅助T细胞的内在分子机制并不清楚。
2月19日,Advanced Science杂志在线发表了田志刚院士团队的最新研究成果”Checkpoint TIPE2 limits the helper functions of NK cells in supporting antitumor CD8+ T cells”,报道了NK细胞辅助CD8+ T细胞抗肿瘤免疫应答的分子机制,并报道了TIPE2分子是NK细胞辅助功能的卡控点分子,靶向敲除NK细胞中TIPE2能同时促进NK细胞及其辅助的CD8+ T细胞抗肿瘤应答。中国科学技术大学田志刚教授、孙昊昱教授及中国科学院深圳先进技术研究院合成生物学研究所毕嘉成副研究员为该文的通讯作者,毕嘉成副研究员同时为该文的第一作者。

文章上线截图
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202207499
免疫治疗的快速发展正在改变肿瘤的治疗范式,然而,并不是所有的患者都能从免疫治疗中受益。在应对实体肿瘤等情况下,免疫治疗仍面临有效性和安全性不足等问题。另一方面,在合成生物学理念与技术的影响与驱动下,当前的免疫治疗研究正往以工程化操控为主要特征的“合成免疫学”新阶段发展,旨在通过设计与构建新型合成免疫分子、合成免疫细胞等,对免疫应答进行理性操控,从而实现肿瘤等重大疾病的免疫治疗。 “卡控点分子/ Immune Checkpoints”(对免疫系统具有重要调节作用的分子)作为合成免疫分子/细胞设计的重要元件,对其进行深入研究不仅能揭示免疫应答的调控规律,而且能提供工程化设计合成免疫分子/细胞的理论依据。因而,“卡控点分子”研究是当前“合成免疫学”研究的关键切入点。
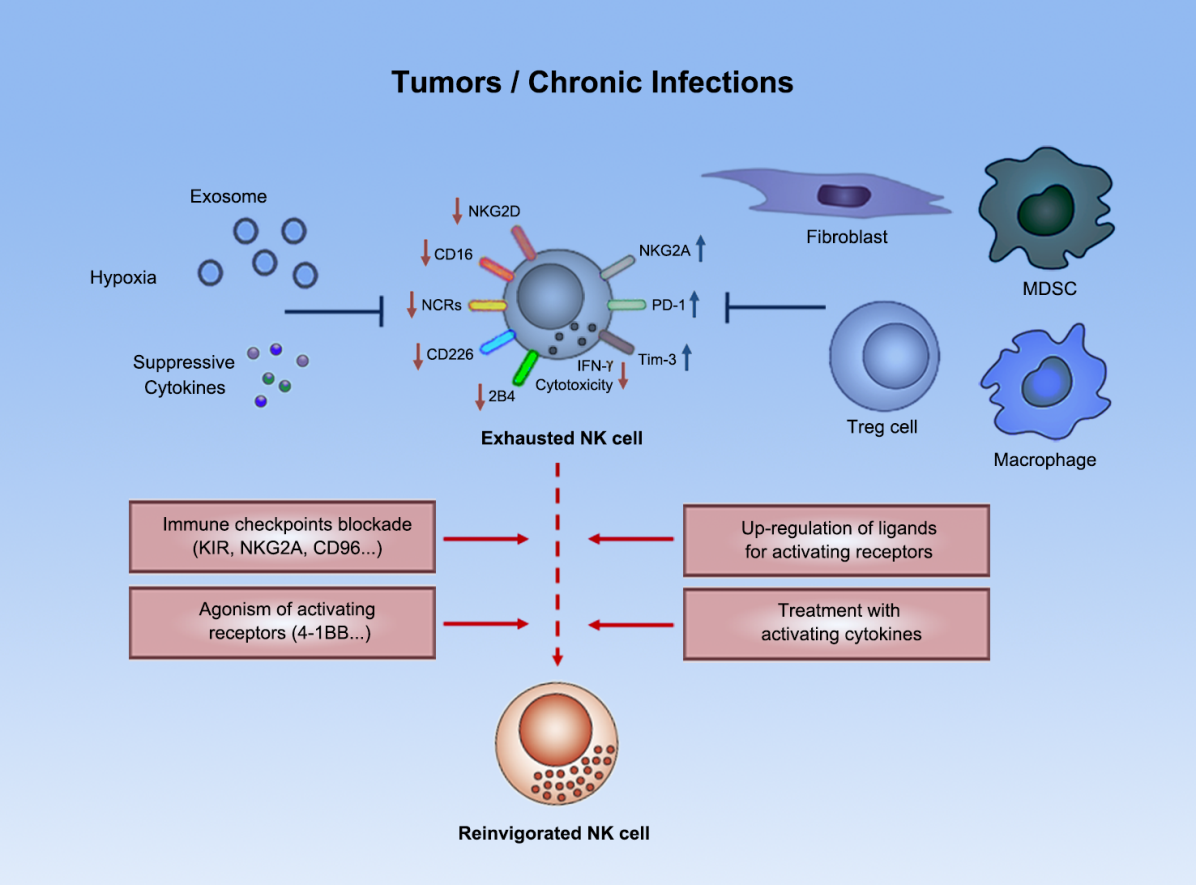
图1. NK细胞在肿瘤微环境中进入功能低下的“免疫耗竭”状态
NK细胞是一种固有免疫细胞,通过杀伤靶细胞、诱导靶细胞凋亡或分泌细胞因子来发挥对肿瘤的免疫监视功能。大量研究早已显示NK细胞不仅在控制血液系统肿瘤及肿瘤转移中发挥关键作用,而且NK细胞在实体肿瘤中的浸润水平也与患者的预后密切相关。NK细胞在当前的肿瘤免疫治疗研究中具有重要的地位,因为NK细胞不仅能识别并杀伤HLA低表达等逃逸T细胞应答的肿瘤细胞类型,而且NK细胞对基于T细胞的免疫治疗(如靶向PD-1/PD-L1的“卡控点疗法”)也具有促进作用,此外NK细胞还天然具有作为“通用型”合成免疫细胞疗法底盘细胞的优势。尽管如此,NK细胞在肿瘤微环境中会受到一系列免疫负调控细胞、分子等的负向调控,进入功能低下的“免疫耗竭”状态(图1)[1, 2];为了充分发挥基于NK细胞的免疫治疗策略的优势,科研团队需要深入揭示肿瘤相关NK细胞的功能调节机制。
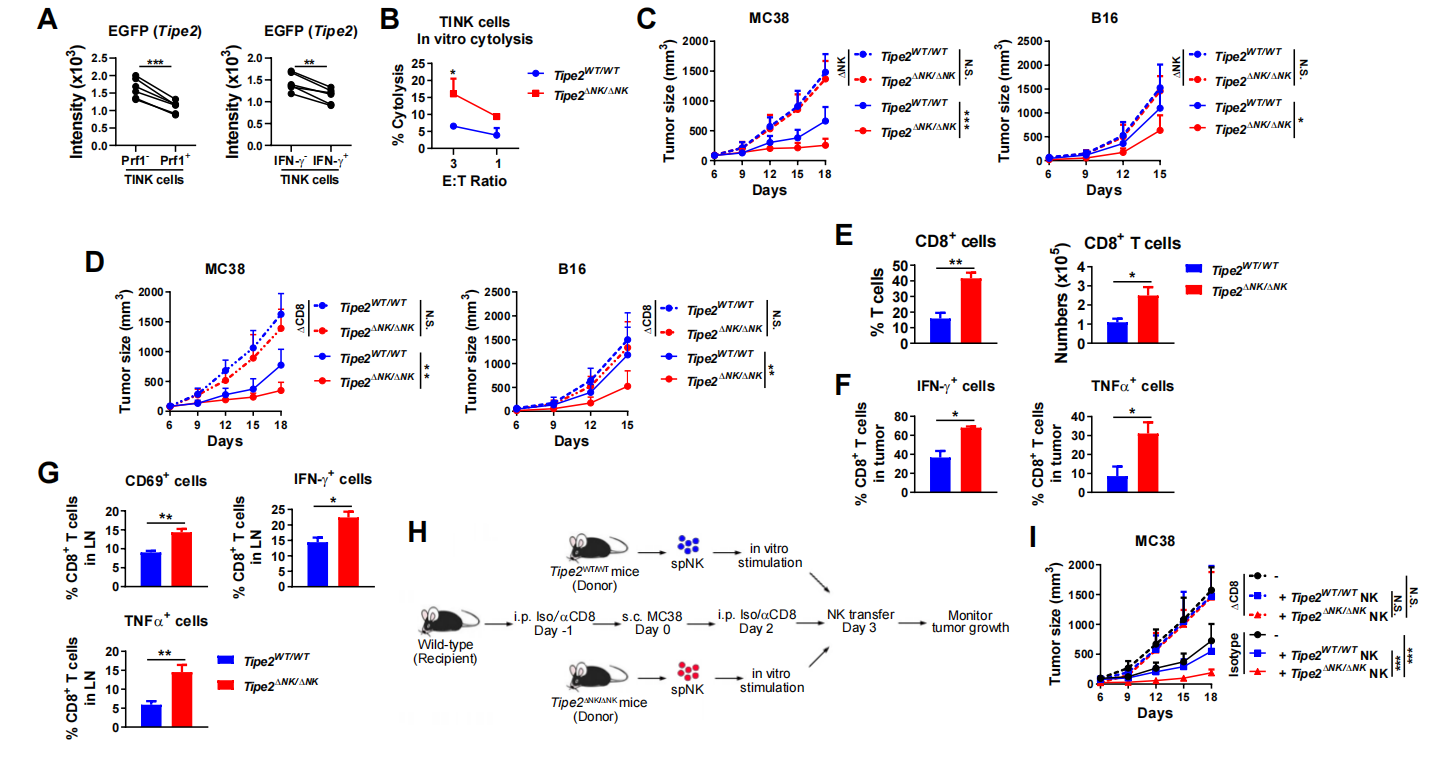
图2. NK细胞敲除Tipe2后促进抗肿瘤CD8+T细胞应答
课题组前期已发现TIGIT(Hepatology 2014a,2014b; Nat Immunol 2018)、A3AR(Cell Mol Immunol 2021)和TIPE2(Science Advances 2021; J ImmunoTher Cancer 2023)等卡控点分子在疾病状态如肿瘤、组织损伤与再生等过程中对NK细胞的功能具有负调控作用[3-8]。其中胞内卡控点分子TIPE2分子在稳态NK细胞中的表达水平与NK细胞的功能成熟相关,且在肿瘤相关NK细胞中的表达水平与NK细胞的功能耗竭状态相关,且高表达TIPE2的NK细胞亚群与肿瘤患者较差的预后显著相关。
研究人员利用常用于研究T细胞抗肿瘤应答的小鼠结肠癌MC38肿瘤模型及黑素瘤B16肿瘤模型,发现NK细胞缺失Tipe2后小鼠体内肿瘤生长显著受到抑制,且该现象同时依赖于NK细胞及CD8+T细胞的存在(图2)。NK细胞缺失Tipe2后肿瘤引流淋巴结及肿瘤局部CD8+T细胞的功能显著增强,且缺失Tipe2的NK细胞转输到MC38荷瘤的小鼠后肿瘤生长显著低于对照组;而若提前清除CD8+ T细胞则无法观察到该效应。因而,结果提示NK细胞中的TIPE2分子间接抑制着CD8+T细胞抗肿瘤应答。
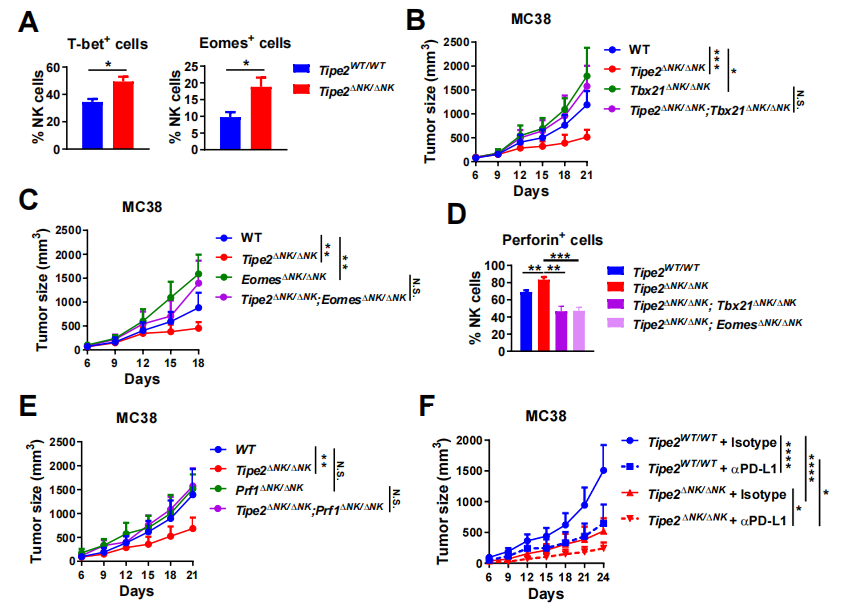
图3. NK细胞敲除Tipe2促进抗肿瘤CD8+T细胞应答的机制
在作用机制方面,由于科研人员观察到肿瘤浸润NK细胞中效应分子IFN-g及perforin表达较高的群体Tipe2表达较低,且Tipe2缺失的肿瘤浸润NK细胞具有更强的杀伤活性(图2),科研团队考虑TIPE2是否通过抑制IFN-g及perforin等效应分子的上游分子,间接抑制NK细胞的效应功能,从而影响CD8+T细胞抗肿瘤应答。团队发现Tipe2缺失后肿瘤浸润NK细胞表达更高水平的转录因子T-bet及Eomes。转录因子T-bet和Eomes促进NK细胞一系列效应分子的转录,对NK细胞的效应功能起关键作用。另一方面,科研团队检测到Tipe2缺失后肿瘤浸润NK细胞也表达更高水平的perforin,且该现象依赖T-bet或Eomes的存在,印证了T-bet/Eomes与NK细胞效应功能之间的紧密联系。重要的是,团队发现NK细胞中Tipe2缺失对肿瘤生长的抑制效应依赖于NK细胞中表达T-bet、Eomes及perforin,这三者之中任意其一若同时缺失的话,肿瘤将恢复加速生长。另一方面,NK细胞Tipe2缺失能够进一步促进抗PD-L1治疗的抗肿瘤效应,提示二者的作用机制之间存在协同效应(图3)。科研团队的研究表明NK细胞TIPE2通过抑制转录因子T-bet和Eomes及其下游的效应分子的表达,间接限制了抗肿瘤CD8+ T细胞的功能,提示TIPE2是NK细胞辅助功能的卡控点分子。
该工作获得了科技部国家重点研发计划、国家自然科学基金、中国科学院定量工程生物学重点实验室、深圳合成生物学创新研究院等项目的支持。
参考文献:
[1] Bi J*, Tian Z*. NK Cell Exhaustion. Frontiers in immunology 2017, 8: 760.
[2] Bi J*, Tian Z*. NK cell dysfunction and checkpoint immunotherapy. Frontiers in immunology 2019, 10: 1999.
[3] Bi J, Zhang Q, Liang D, Xiong L, Wei H, Sun R*, Tian Z*. T-cell Ig and ITIM domain regulates natural killer cell activation in murine acute viral hepatitis. Hepatology2014, 59(5): 1715-1725.
[4] Bi J, Zheng X, Chen Y, Wei H, Sun R*, Tian Z*. TIGIT safeguards liver regeneration through regulating natural killer cell-hepatocyte crosstalk. Hepatology 2014, 60(4): 1389-1398.
[5] Zhang Q, Bi J, Zheng X, Chen Y, Wang H, Wu W, Wang Z, Wu Q, Peng H, Wei H, Sun R*, Tian Z*. Blockade of the checkpoint receptor TIGIT prevents NK cell exhaustion and elicits potent anti-tumor immunity. Nat Immunol 2018, 19(7): 723-732.
[6] Bi J, Zheng C, Zheng X. Increased expression of adenosine A3 receptor in tumor-infiltrating natural killer cells. Cell Mol Immunol 2021, 18(2): 496-497.
[7] Bi J*, Cheng C, Zheng C, Huang C, Zheng X, Wan X, Chen YH, Tian Z, Sun H*. TIPE2 is a checkpoint of natural killer cell maturation and antitumor immunity. Science Advances, 2021, 7(38):eabi6515
[8] Bi J*, Huang C, Jin X, Zheng C, Huang Y, Zheng X, Tian Z*, Sun H*. TIPE2 deletion improves the therapeutic potential of adoptively transferred NK cells. J ImmunoTher Cancer, 2023.