
如果说微生物细胞是一个微型工厂,那么细胞内的酶就是这个工厂内的机器,这些纳米级别的机器无时不刻地催化着细胞内的多种化学反应。天然的生物催化体系通常在微生物细胞这个微型工厂内会形成物理上、空间上组织有序的多酶复合体、酶分子脚手架或者反应微区,这种类似机器组装的高度组织性带来了高效的催化能力。
然而,人工构建的合成体系多不存在这种高效的组织性,由此引发的目标途径合成效率低、代谢流不平衡等问题,很大程度上限制了人工合成体系的生物制造潜力。
北京时间9月22日,中科院深圳先进技术研究院马田副研究员、武汉大学刘天罡教授团队与邓子新院士合作在Nature Communications上发表题为“Metabolic pathway assembly using docking domains from type I cis-AT polyketide synthases”的研究成果。该研究模拟了天然模块聚酮合酶的有序组装,开发的mPKSeal策略能够有效提高人工细胞工厂的合成效率。

文章上线截图
文章链接:https://doi.org/10.1038/s41467-022-33272-2
该研究通过模拟天然模块聚酮合酶 (PKS) 高度有序的组装方式,利用其中研究较多的I型cis-AT聚酮合酶对接域,开发了“mimic PKS enzyme assembly line (mPKSeal)”多酶组装策略(图1),并应用于虾青素合成途径酶的组装,虾青素的产量最高提高了2.4倍 (产量达16.9 mg/g DCW)。这是该研究团队继RIAD/RIDD双酶组装策略[1]之后的又一多酶组装策略的开发,前者已在不同报道中显示出其良好的应用潜力[2,3],而mPKSeal策略不再局限于两种酶的组装,而是可拓展为同一体系中的多种酶有序组装,且潜在的组装元件个数超万,可为生物催化、代谢工程及合成生物学等相关领域提供更广泛有效的提高合成效率的解决方案。
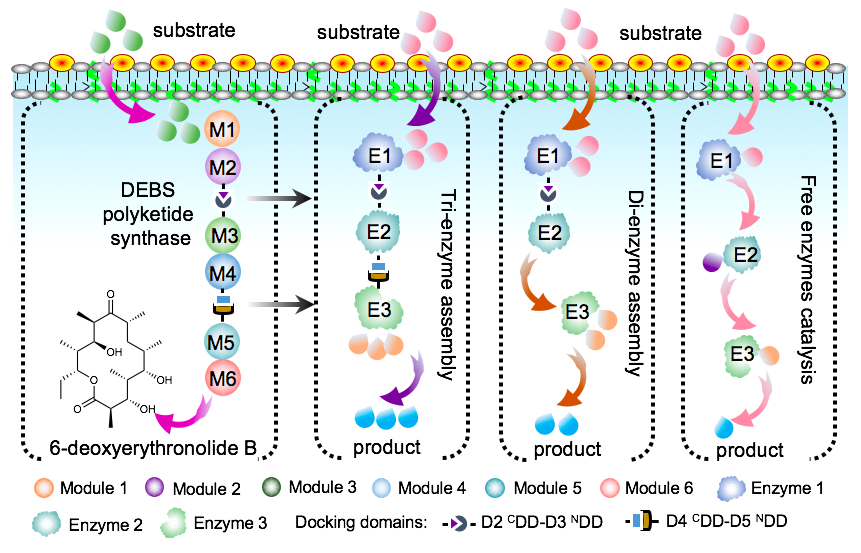
图 1. mPKSeal多酶组装策略(以红霉素聚酮合酶DEBS为例)
对接域的体内体外组装研究。为了验证从天然PKS系统中剥离出来的相互作用元件-对接域的识别与组装能力,本研究分别在体外和体内实验中验证了独立于聚酮合酶的对接域仍保持着良好的相互作用能力。体外实验评估了来源于红霉素聚酮合酶(DEBS)和雷帕霉素聚酮合酶(RAPS)对接域相互作用的动力学参数(图2),体内实验利用荧光蛋白的定位变化验证了对接域介导非PKS的异源酶组装能力(图3)。
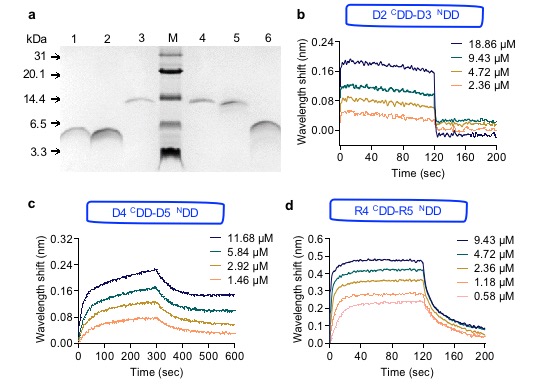
图2. 体外评估对接域的相互作用力
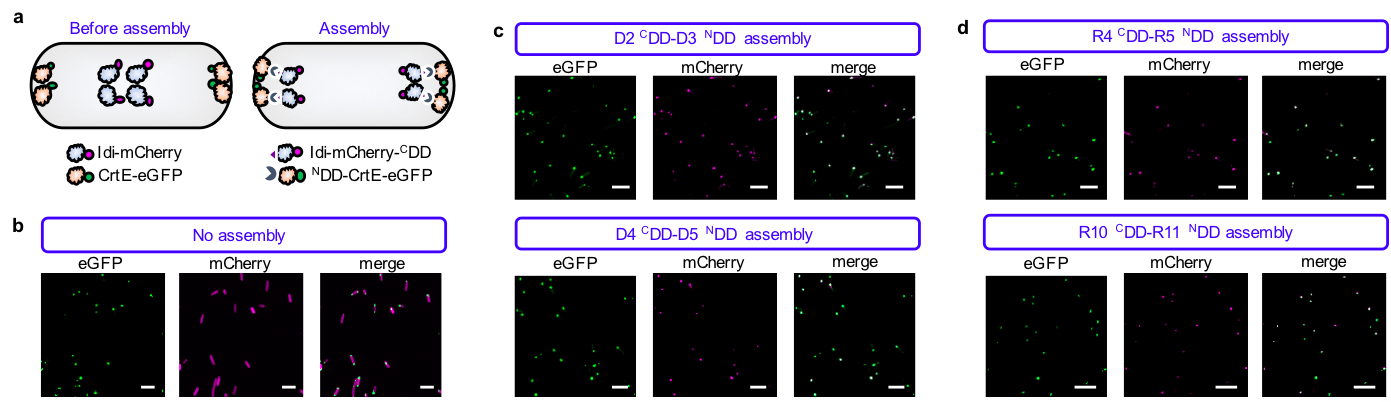
图3. 体内验证对接域介导非PKS的异源酶组装能力
mDEBSeal策略用于虾青素代谢途径酶组装。在前期研究中,研究团队已经构建了一株虾青素高产菌株。在研究中发现,该菌株表现出代谢中间体的积累(Ac-CoA、acetoacetyl-CoA、IPP/DMAPP及beta-carotene)。因此,为了减少中间体的积累,进一步提高虾青素的产量,在本研究中,作者将源于DEBS的mDEBSeal策略用于虾青素代谢途径酶组装:将细胞内不同空间分布的虾青素代谢途径酶进行质膜酶多组合组装。结果表明,组装菌株中虾青素产量均有提高,其中在胞质-胞膜三酶组装(Idi-CrtE-CrtB)菌株A8中,虾青素产量提高了2.4倍,达到16.9 mg/g DCW(图4)。

图 4. mDEBSeal策略用于虾青素代谢途径酶组装
来源于天然I型cis-AT PKS的对接域形成的mPKSeal策略研究。目前,自然界中已经被鉴定的I型cis-AT PKS超过1600种,这些多样的PKS系统含有多样的对接域。为了拓展mPKSeal的应用潜力,作者进一步探究了来源于不同PKS的mAURSeal、mFKBSeal及mRAPSeal策略的应用。结果表明,三个策略的应用使虾青素的产量均表现出明显的提升(图5)。由此表明,来源于不同天然I型cis-AT PKS的对接域同样能够用于mPKSeal策略。
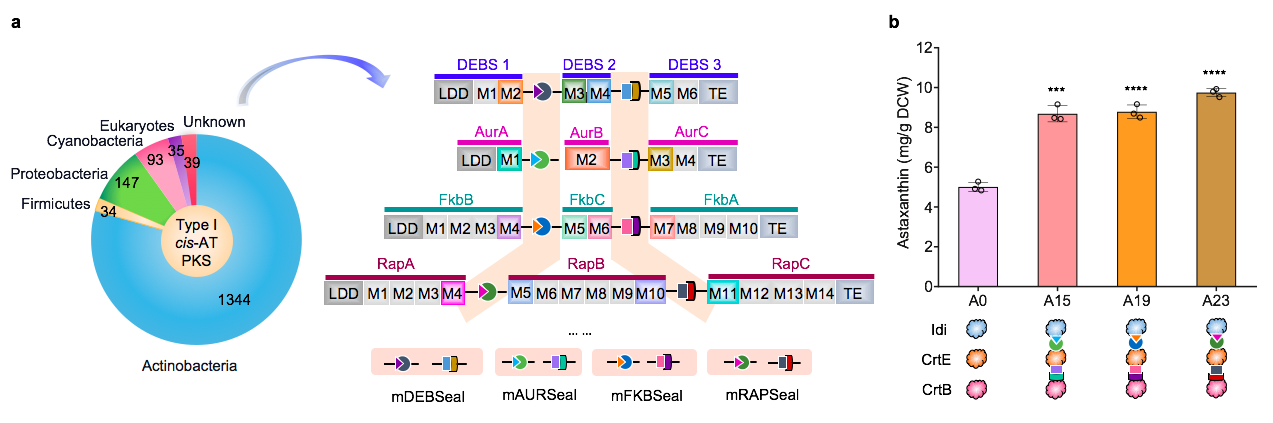 图 5. 不同天然I型cis-AT PKS的mPKSeal策略研究
图 5. 不同天然I型cis-AT PKS的mPKSeal策略研究
由不同分类的对接域形成的mPKSeal策略研究。在前期研究中,基于蛋白-蛋白共进化的生物系统聚类分析,研究人员将不同PKS来源的对接域进一步划分为不同类别:H1a–T1a, H1b–T1b,H2–T2等。为了进一步探究不同类别对接域组合应用的潜力,作者测试了来自不同PKS的多组不同类别的对接域组合应用,发现即使是不同PKS的对接域在同一分类下仍然能够有序组装,并实现虾青素产量的提升(图6)。
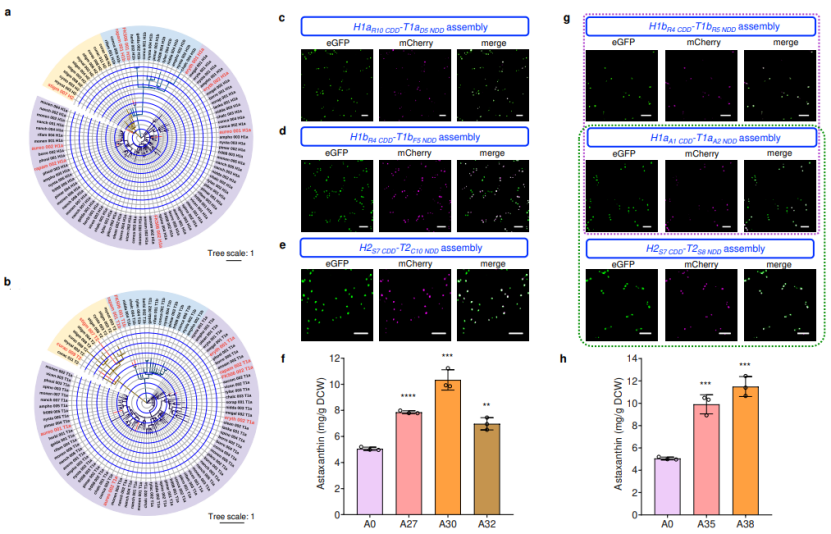
图 6. 不同分类对接域的mPKSeal策略研究
本研究开发的mPKSeal策略一方面为天然产物的高效合成提供了一种新策略;另一方面,mPKSeal策略中上万个潜在的组装元件,有望突破现有组装元件的个数,并改善同一体系中组装不同对象数量上的限制,为更广泛的应用场景提供工具和策略选择。