12月19日,中国科学院深圳先进技术研究院合成生物学研究所金帆课题组在国际学术期刊Microbiology Spectrum上发表了题为《AIDmut-Seq: A three-step method for detecting protein-DNA binding specificity》的研究成果。该研究发展了一种检测转录因子结合位点(transcription factor binding sites, TFBS)的新方法,通过诱导转录因子-胞嘧啶脱氨酶融合蛋白表达、高通量测序和单核苷酸多态性(SNP)分析,获得转录因子的全基因组结合位点信息。
中科院深圳先进院合成所助理研究员倪磊、研究员金帆为共同通讯作者。
文章上线截图
文章链接:https://doi.org/10.1128/spectrum.03783-22
转录因子能够以特定序列与基因专一性结合,保证目的基因以特定的强度在特定的时间空间表达。转录因子和DNA的相互作用在基因调控网络(GRNs)中起着核心作用。目前检测转录因子-DNA结合特异性的主要方法需要先对转录因子结合的DNA片段进行捕获富集然后再进行测序(或其他分析),如染色质免疫沉淀 (ChIP)、配体系统进化指数富集(SELEX)和DNA亲和纯化测序(DAP-Seq)等。这些方法涉及复杂的实验程序,如基因组DNA的碎片化和扩增、转录因子的免疫沉淀等,较高的操作门槛不利于新手或跨学科人员快速展开实验。
在本研究中,金帆团队开发了一种名为AIDmut-Seq的体内方法。活化诱导胞苷脱氨酶(AID)可以将单链DNA序列中的碱基C脱氨化形成碱基U, DNA复制后发生C-T或G-A替代。研究人员将AID融合到转录因子上,并在体内诱导融合蛋白表达,这样就可以在转录因子结合位点附近引入突变,后续可以通过全基因组测序直接检测。由于不需要对转录因子结合的片段进行捕获富集,而仅需对突变标记进行测序,因此AIDmut-Seq的整个工作流程仅包含细菌培养、基因组提取和生信分析三个步骤(图 1),不涉及其他复杂的实验操作,大大节省了实验人员的时间和劳动成本。

图1 AIDmut-Seq的原理和步骤
研究人员使用不同类型的转录调节因子对AIDmut-Seq进行了验证,表明该方法对大多数转录激活因子(如LasR,FleQ,ErdR,GacA,ExsA等)的具有较高效率。而对一些小的转录抑制因子(如RsaL和AmrZ等)虽然表现出较低的效率,但通过该方法计算得到的转录因子识别基序(motif)和现有方法得到的基序具有很大相似性。此外,使用AIDmut-Seq还得到了许多之前没有发现的转录因子结合位点和新的调节模式。这些结果证明了AIDmut-Seq的高效性和泛用性,可以作为现有方法的重要补充工具(图2)。
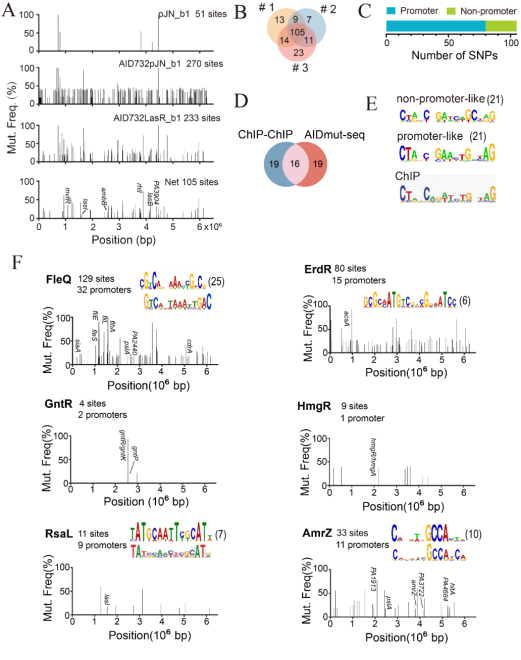
图2 AIDmut-Seq适用于大多数转录因子
研究人员将ADImut-Seq与目前最常用的ChIP-seq进行了“标杆测试”(benchmarking)。比较发现, AIDmut-Seq和ChIP-seq对TFBS具有相似的检测精度,但AIDmut-seq具有更窄的检测窗口。尤其对于启动子上存在多个结合位点的位置,AIDmut-Seq相比ChIP-seq具有更好的分辨率,因此AIDmut-Seq在识别同一启动子中的多个结合位点具有潜在的优势(图3)。

图3 AIDmut-Seq与ChIP-seq的比较
该研究得到了科技部重大研发计划、国家自然科学基金、中国科学院科学仪器开发和深圳合成生物学创新研究院等项目支持。




