
团队成员郑灵刚和谭扬为共同第一作者,该工作得到了国家重点研发计划合成生物学重点专项青年科学家项目(No.2019YFA0906700)与深圳合成生物学创新研究院的资助。

肠道拟杆菌属是肠道中丰度最高的细菌之一(如图1所示),被视为研究肠道微生物组的“窗口”。
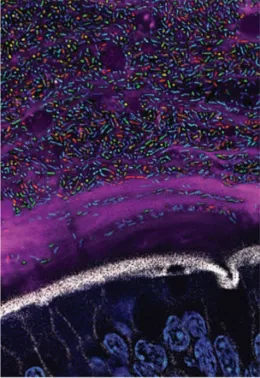
图1 肠道组织样本中含荧光蛋白的不同拟杆菌成像(Whitaker et al, Cell 2017)
拟杆菌属与多种疾病相关,比如肥胖,炎症性肠病和结直肠癌等,其中多形拟杆菌和脆弱拟杆菌最为受到关注。基因组编辑工具对于研究肠道共生微生物的功能至关重要。因此,该团队设计了针对人体肠道拟杆菌的多功能、高效的 CRISPR/Cas 编辑工具(如图2所示)。

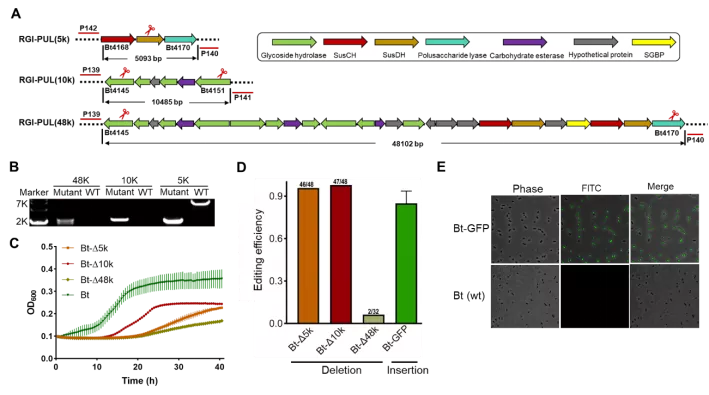
该团队在拟杆菌属中测试了不同的CRISPR/Cas系统。主要评估了启动子,Cas蛋白(SpCas9,SpRY,和FnCas12a),gRNA等元件,以及不同质粒的系统对于拟杆菌属基因编辑的影响。并发现在多形拟杆菌中采用正常组成型启动子表达Cas蛋白,CRISPR/Cas系统无法实现编辑,但是使用诱导型启动子表达Cas蛋白,均可以实现基因编辑;其中FnCas12a效果最好。基于此,团队测试该系统在多形拟杆菌中可以实现5kb、10kb、48kb基因簇片段的删除和外源基因GFP的高效插入。此外,也可通过在无筛选标记的培养基中传代,进行含有筛选标记的质粒的丢失,实现获得“无筛选标记(markerless)”的突变株(如图3所示)。
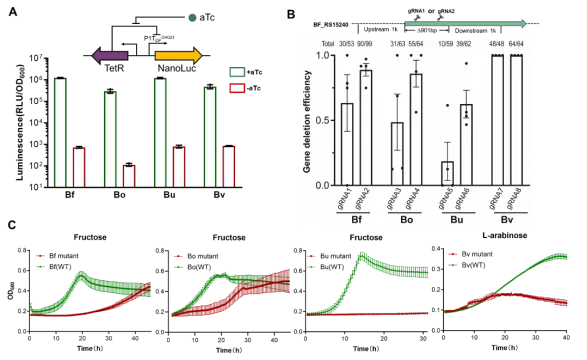
除此之外,该系统也可以在卵形拟杆菌(Bo),脆弱拟杆菌(Bf),普通拟杆菌(Bv),和单形拟杆菌(Bu)实现高效率的基因删除。(如图4所示)
与之前针对拟杆菌属基因基因遗传操作工具相比,该团队基于CRISPR/Cas系统的工具极大的提高了拟杆菌属基因编辑的效率,同时也更容易实现无筛选标记突变株的获得。高效、精准的基因组编辑方法对于解析肠道微生物组的功能、开发工程肠道益生菌都是不可或缺的工具。
PI与课题组简介:
戴磊博士,研究员,中科院深圳先进技术研究院合成生物学研究所,合成微生物组学研究中心主任。国家重点研发计划青年项目负责人,入选《麻省理工科技评论》中国区“35岁以下科技创新35人”。
戴磊课题组的主要研究方向为宿主共生微生物组的生态和进化。运用定量生物学、合成生物学的工具,对微生物组的结构和功能进行精准解析和调控,致力于解决人体健康、农业生产等重大问题。
拟招聘具有微生物学、合成生物学、生物信息学等相关研究背景博士后1-2名,客座学生1-2名。有意申请者请将个人简历以邮件方式发送至 lei.dai@siat.ac.cn。
实验室主页:
http://www.leidailab.cn/